题目内容
【题目】为了探究铁、铜、银的活动性顺序,小松同学和小雷同学做了如下实验。请回答下列问题及填写相关空白。
(实验探究)小松同学向盛有硫酸铜和氯化钠溶液的烧杯中插入银片和铁片,发生反应的化学方程式为______。根据______的现象,判断出铁、铜、银的活动性顺序为:铁>铜>银。

(交流讨论)小雷同学想探究一下取出金属片后C烧杯内物质的成分,并进行了如下猜想:
猜想一:NaCl、FeSO4
猜想二:NaCl、CuSO4
猜想三:NaCl、CuSO4、FeSO4
小松认为猜想______一定是错误的,理由是______;
(归纳总结)你认为分析反应后所得溶液中溶质的成分时需要考虑的物质是______;
(表达交流)总结小松和小雷同学的探究历程,猜想一和猜想三都有可能是正确的,有关化学反应后溶液中溶质的成分的猜想,你能总结关于溶液中溶质的成分的猜想的规律是______。
【答案】CuSO4+Fe=FeSO4+Cu 铁片表面覆盖一层紫红色固体,溶液的颜色由蓝色变为浅绿色 二 烧杯中一定含有反应生成的硫酸亚铁 可溶性的生成物、剩余的可溶性反应物、不参加反应的可溶性物质 可溶性生成物一定含有,可溶于水的反应物可能含有,不参加反应的可溶于水物质一定含有
【解析】
铁和硫酸铜反应生成硫酸亚铁和铜,银不能和硫酸铜反应;反应后所得溶液中溶质的成分时需要考虑的物质是可溶性的生成物、剩余的可溶性反应物、不参加反应的可溶性物质;关于溶液中溶质的成分的猜想的规律是可溶性生成物一定含有,可溶于水的反应物可能含有,不参加反应的可溶于水物质一定含有。
(1)铁和硫酸铜反应生成硫酸亚铁和铜,反应的化学方程式为:CuSO4+Fe=FeSO4+Cu;
(2)实验过程中,铁片表面覆盖一层紫红色固体,溶液的颜色由蓝色变为浅绿色,是因为铁和硫酸铜反应生成硫酸亚铁和铜,说明铁比铜活泼;银片表面无明显变化,说明银不能和硫酸铜反应,进一步说明铜比银活泼,因此判断出铁、铜、银的活动性顺序为:铁>铜>银;
(3)猜想二一定是错误的;
(4)理由是烧杯中一定含有反应生成的硫酸亚铁;
(5)分析反应后所得溶液中溶质的成分时需要考虑的物质:可溶性的生成物、剩余的可溶性反应物、不参加反应的可溶性物质;
(6)关于溶液中溶质的成分的猜想的规律是:可溶性生成物一定含有,可溶于水的反应物可能含有,不参加反应的可溶于水物质一定含有。

【题目】火锅是我国独创的美食,历史悠久。火锅常用的一种燃料是固体酒精。某化学兴趣小组的同学对“固体酒精”产生了好奇,对其成分进行探究。请你回答下列问题。
(查阅资料)(1)、固体酒精是用酒精、氯化钙和氢氧化钠按一定的质量比混合制成。
(2)、氯化钙溶液和酒精溶液均呈中性。
(提出问题)固体酒精中的氢氧化钠是否变质?
(实验探究)
(1)、取少量固体酒精于烧杯中,加足量的水充分溶解后静置,发现烧杯底部有白色沉淀,请用化学方程式表示该沉淀是如何形成的_____,由此说明氢氧化钠已变质。
(2)、为进一步确定氢氧化钠的变质程度,分组进行探究。
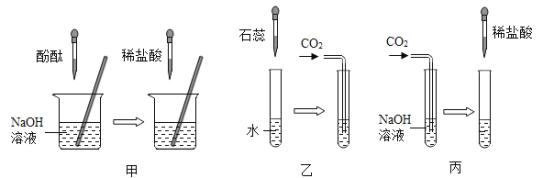
甲组同学取烧杯上层清液于两支试管中,按如图所示进行实验。
实验方案 |
|
|
实验现象 | 溶液变红 | 产生_____ |
实验结论 | 清液中有氢氧化钠 | 清液中有碳酸钠 |
乙组同学认为甲组实验不能证明清液中一定有氢氧化钠,理由是_____。
他们另取烧杯中上层清液,加足量氯化钙溶液,充分反应后,静置,取上层清液,滴加酚酞溶液,酚酞溶液变红。
(反思交流)(1)、乙组实验中加足量氯化钙溶液的目的是_____。
(2)、乙组实验中能否用澄清石灰水代替氯化钙溶液_____(填“能”或“不能”)。