题目内容
【题目】了解物质的组成和结构,有助于认识物质的性质和变化。
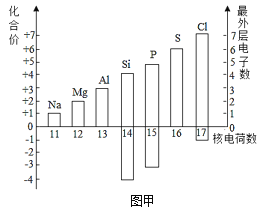
(1)图甲表示核电荷数为11~17的元素最高和最低化合价和原子的最外层电子数。
①若某元素既可显正价,又可显负价,则最高正价与最低负价绝对值的代数和为_____。硫元素既可显正价,又可显负价,硫元素与钠元素形成的化合物由_____(填“分子”、“原子”或“离子”)构成,其化学式为_____。
②铝原子失去最外层电子所形成的离子符号为_____。
③写出图中元素的化合价与最外层电子数有关的一条规律_____。
(2)将NaOH、KCl、MgCl2三种溶液按一定比例混合,微观变化情况如图乙。
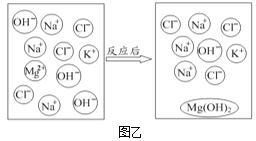
①图中OH-的名称是_____。
②该反应的本质是_____结合生成沉淀。
③写出与上述反应本质相同的另一反应的化学方程式:_____(反应物之一为MgCl2)。
【答案】8 离子 Na2S Al3+ 最高正价的绝对值=最外层电子数(最低负价的绝对值=8-最外层电子数) 氢氧根离子 Mg2+和OH- MgCl2+2KOH=Mg(OH)2↓+2KCl
【解析】
(1)①若某元素既可显正价,又可显负价,则最高正价与最低负价绝对值的代数和为=|+7|+|-1|=8;硫元素与钠元素形成的化合物还硫化钠,;硫化钠由钠离子和硫离子构成,其化学式为Na2S。
故填:8;离子;Na2S。
②铝原子失去3个电子,带3个单位的正电荷,故离子符号为:Al3+;
③元素的化合价与最外层电子数的关系是:最高正价的绝对值=最外层电子数(最低负价的绝对值=8-最外层电子数);
(2)①图中OH-的名称是氢氧根离子。
②氯化镁和氢氧化钠反应生成氢氧化镁和氯化钠,该反应的本质是Mg2+和OH-结合生成沉淀。
③氯化镁和氢氧化钾反应生成氢氧化镁沉淀和氯化钾,反应的方程式为:MgCl2+2KOH=Mg(OH)2↓+2KCl。

【题目】水和溶液对于人类的生产和生命活动有重大的意义。
(1)能说明水是由氢元素和氧元素组成的实验是_____(填序号)。
A 水的净化 B 通电分解水 C 氢气在氧气中燃烧
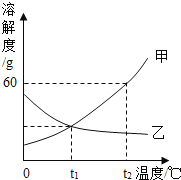
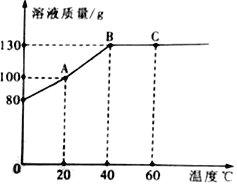
(2)下表是三种物质在不同温度时的溶解度,根据表中信息回答问题。
温度/℃ | 0 | 20 | 40 | 60 | 80 | |
溶解度 |
|
|
|
|
|
|
| 119 | 190 | 286 | 421 | 630 | |
|
|
|
|
|
| |
①20℃时,将![]() 加入到
加入到![]() 水中充分搅拌后,所得溶液的质量为_____
水中充分搅拌后,所得溶液的质量为_____![]() 。
。
②40℃时,要使接近饱和的![]() 溶液变为饱和溶液,下列方法中一定能达到目的的是_____(填序号)。
溶液变为饱和溶液,下列方法中一定能达到目的的是_____(填序号)。
A 升高温度 B .加溶质![]() C .加水 D 恒温蒸发水
C .加水 D 恒温蒸发水
③60℃时,分别用![]() 、
、![]() 制成饱和溶液,需要水的质量
制成饱和溶液,需要水的质量![]() _____
_____![]() (填“>”、“=”或“<”)。
(填“>”、“=”或“<”)。
④80℃时,向![]() 饱和溶液和
饱和溶液和![]() 饱和溶液中分别加入等量(少量)的
饱和溶液中分别加入等量(少量)的![]() 固体,在溶解过程中由饱和溶液变为不饱和溶液的是_____(填溶质的化学式)。
固体,在溶解过程中由饱和溶液变为不饱和溶液的是_____(填溶质的化学式)。
⑤某![]() 晶体中有少量
晶体中有少量![]() 和
和![]() 杂质,要得到纯净
杂质,要得到纯净![]() 的方法是:在80℃,向其中逐渐加水至全部溶解,然后_____、过滤、洗涤、干燥后得到
的方法是:在80℃,向其中逐渐加水至全部溶解,然后_____、过滤、洗涤、干燥后得到![]() 晶体。
晶体。
(3)实验室模拟工业粗盐精制的过程如下图所示。粗盐除含![]() 外,还含有少量
外,还含有少量![]() 、
、![]() 、
、![]() 和泥沙等杂质。
和泥沙等杂质。
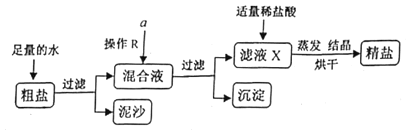
提供的试剂:![]() 溶液、
溶液、![]() 溶液、
溶液、![]() 溶液、
溶液、![]() 溶液、
溶液、![]() 溶液、饱和
溶液、饱和![]() 溶液。
溶液。
①过滤时使用玻璃棒的作用是_____。
②欲除去混合液中的杂质,从提供的试剂中选出![]() 所代表的除杂试剂,按滴加顺序依次为:过量的_____溶液、过量的
所代表的除杂试剂,按滴加顺序依次为:过量的_____溶液、过量的![]() 溶液、过量的
溶液、过量的![]() 溶液。
溶液。
③滤液![]() 中加入适量盐酸的目的是_____。
中加入适量盐酸的目的是_____。
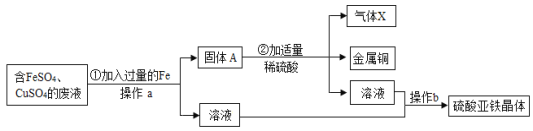
④为充分反应得到较纯净的食盐,操作![]() 的具体方法是____。
的具体方法是____。