题目内容
(6分)在一次探究活动中,小强用塑料吸管向新制的澄清石灰水中不断吹气,在吹气的过程中发现石灰水先出现浑浊后又变澄清,他感到很意外.小强又将纯净的CO2持续通入新制的澄清石灰水中,一段时间后,观察到的现象与上次相同。
(1)小强做第二次实验的目的是 .
(2)小强从老师那里得知:CO2能与CaCO3和H2O继续反应生成Ca(HCO3)2.由此小强推测出Ca(HCO3)2的一条物理性质是 .
(3)小强还想了解Ca(HCO3)2的化学性质.查阅资料后得知碳酸氢钙[Ca(HCO3)2]受热易分解,生成难溶性的化合物、气体等物质.他与同学们一起对碳酸氢钙受热分解后产物的成分进行了探究.
【提出猜想】
猜想1.生成的难溶性化合物可能是碳酸钙.经实验探究结论正确.
猜想2.放出的气体可能是O2、H2、CO、CO2中的一种或几种.
【实验探究】
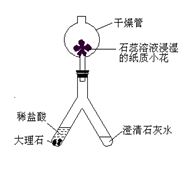
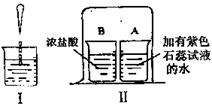
小强同学设计如下实验,探究气体的成分.

操作1.加热A装置,一段时间后,B装置中的澄清石灰水变浑浊.
操作2.在a处用燃着的木条检验,无明显变化.
【实验结论】
结论1.碳酸氢钙分解产生的气体一定有 .
结论2.碳酸氢钙受热分解的化学方程式为Ca(HCO3)2 CaCO3+CO2↑
CaCO3+CO2↑
【表达交流】
交流1.从安全的角度考虑,操作2实验中存在的不足是 .
交流2.小组内某同学对上述结论提出异议:
(1)小强做第二次实验的目的是 .
(2)小强从老师那里得知:CO2能与CaCO3和H2O继续反应生成Ca(HCO3)2.由此小强推测出Ca(HCO3)2的一条物理性质是 .
(3)小强还想了解Ca(HCO3)2的化学性质.查阅资料后得知碳酸氢钙[Ca(HCO3)2]受热易分解,生成难溶性的化合物、气体等物质.他与同学们一起对碳酸氢钙受热分解后产物的成分进行了探究.
【提出猜想】
猜想1.生成的难溶性化合物可能是碳酸钙.经实验探究结论正确.
猜想2.放出的气体可能是O2、H2、CO、CO2中的一种或几种.
【实验探究】
小强同学设计如下实验,探究气体的成分.

操作1.加热A装置,一段时间后,B装置中的澄清石灰水变浑浊.
操作2.在a处用燃着的木条检验,无明显变化.
【实验结论】
结论1.碳酸氢钙分解产生的气体一定有 .
结论2.碳酸氢钙受热分解的化学方程式为Ca(HCO3)2
 CaCO3+CO2↑
CaCO3+CO2↑【表达交流】
交流1.从安全的角度考虑,操作2实验中存在的不足是 .
交流2.小组内某同学对上述结论提出异议:
| 该同学的观点 | 你是否赞同该观点并阐述理由 |
| 该实验没有对氧气进行验证 | |
| “结论2”不正确 | |
⑴排除其他气体的干扰。(或验证该现象只与二氧化碳有关等)(合理即可)
⑵Ca(HCO3)2能溶于水(或易溶于水)
⑶结论1.CO2(或二氧化碳)
交流1.没有检验气体的纯度或有可能发生爆炸等(根据猜想2给出的气体,合理即可)
交流2. 不赞同此观点.因为氧气具有助燃性,若有氧气产生,实验操作2中的木条燃烧的会更旺.
赞同此观点.根据质量守恒定律,反应前后原子的种类和数目不变,反应前有氢原子,反应后又无氢气生成,所以应有水生成.(或反应物中含有氢元素,生成物中不含氢元素,不遵守质量守恒定律等)
⑵Ca(HCO3)2能溶于水(或易溶于水)
⑶结论1.CO2(或二氧化碳)
交流1.没有检验气体的纯度或有可能发生爆炸等(根据猜想2给出的气体,合理即可)
交流2. 不赞同此观点.因为氧气具有助燃性,若有氧气产生,实验操作2中的木条燃烧的会更旺.
赞同此观点.根据质量守恒定律,反应前后原子的种类和数目不变,反应前有氢原子,反应后又无氢气生成,所以应有水生成.(或反应物中含有氢元素,生成物中不含氢元素,不遵守质量守恒定律等)
试题分析:(1)小强做第二次实验的目的是为了排除其它气体或物质的干扰,以保证实验的科学性;
(2)小强发现向石灰水中不断吹入CO2气体,石灰水先浑浊后澄清,CO2先与Ca(OH)2反应生成沉淀物CaCO3,而CO2又能与CaCO3和H2O继续反应生成Ca(HCO3)2,变为澄清溶液,说明Ca(HCO3)2能溶于水;
(3)结论1:由B装置中的澄清石灰水变浑浊可以说明一定有二氧化碳生成;
交流1:若猜想2成立,生成物中有CO、H2等可燃性气体,若不纯直接点燃就有可能发生爆炸;
交流2:由于氧气具有助燃性,若有氧气产生,实验操作2中的木条会燃烧的更旺,故不赞同此观点;
根据质量守恒定律可知,化学反应前后元素的种类不变,反应前Ca(HCO3)2含有Ca、H、C、O四种元素,而反应后CaCO3、CO2则只含有Ca、C、O三种元素,没有氢元素,结论2不正确。
点评:本题考查了常见物质的性质,完成此题,可以依据已有的知识进行。

练习册系列答案
相关题目