题目内容
【题目】气体制备、收集是初中化学的重要知识。请你结合如图,回答有关问题。

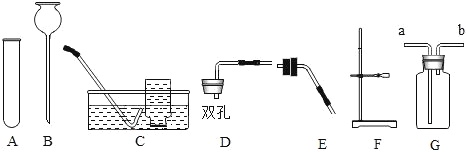
(1)写出图中仪器b的名称:_____。
(2)实验室用氯酸钾制取氧气应选择的发生装置是_____(填字母), 用E装置收集氧气,则气体应从_____ (填“①”或“②”) 端进入。写出该反应的化学方程式_____。
(3)实验室可用装置C代替装置B制取二氧化碳,其优点是_____;写出实验室制取二氧化碳的化学方程式:_____;如果用E装置收集二氧化碳,验满方法是:_____。
(4)实验室用C装置制取氢气,则锌粒放在_____;若要干燥氢气,可将气体通入装有_____(填试剂名称)的D装置中。
(5)已知用氯化铵(固体)与熟石灰(固体)混合加热可制取氨气,且氨气易溶于水,密度比空气小,则实验室制取并收集氨气,应选择的发生装置和收集装置为_____(填序号)。
【答案】锥形瓶 A ①  随时控制反应的发生或停止 CaCO3+2HCl=CaCl2+CO2 ↑+ H2O 用燃着的木条伸到②管口处,木条熄灭,则收集满 多孔隔板上面 浓硫酸 AG(或)AE
随时控制反应的发生或停止 CaCO3+2HCl=CaCl2+CO2 ↑+ H2O 用燃着的木条伸到②管口处,木条熄灭,则收集满 多孔隔板上面 浓硫酸 AG(或)AE
【解析】
(1)由图可知b为锥形瓶,故填:锥形瓶。
(2)实验室用氯酸钾制取氧气化学方程式为 该反应需要加热故发生装置选A,用E装置收集氧气,因为氧气密度大于空气密度,则气体应从长管①端进入,故填:A;①;
该反应需要加热故发生装置选A,用E装置收集氧气,因为氧气密度大于空气密度,则气体应从长管①端进入,故填:A;①; 。
。
(3)实验室用石灰石或大理石和稀盐酸反应制取二氧化碳化学方程式为CaCO3+2HCl=CaCl2+CO2 ↑+ H2O,用装置C代替装置B制取二氧化碳,其优点是在装置C中,固体药品放在多孔隔板上,液体药品从长颈漏斗中加入,反应开始后,关闭开关时,试管中的气体增多,压强增大,把液体压入长颈漏斗,固体和液体分离,反应停止,打开开关时,气体导出,试管中的气体减少,压强减小,液体和固体混合,反应进行。实验室常用装置C代替装置B制取气体,装置C的优点是可以随时控制反应的发生与停止。如果用E装置收集二氧化碳,用燃着的木条伸到②管口处,木条熄灭,则收集满,故填:随时控制反应的发生或停止;CaCO3+2HCl=CaCl2+CO2 ↑+ H2O;用燃着的木条伸到②管口处,木条熄灭,则收集满。
(4)实验室用C装置制取氢气,则锌粒放在多孔隔板上面,若要干燥氢气,可将气体通入装有浓硫酸的D装置中,故填:多孔隔板上面;浓硫酸。
(5)用氯化铵(固体)与熟石灰(固体)混合加热可制取氨气,反应加热发生装置选A,氨气易溶于水,密度比空气小,故只能用向下排空气法收集,收集装置选G或E,故填:AG或AE。

 期末1卷素质教育评估卷系列答案
期末1卷素质教育评估卷系列答案【题目】碳酸钠用途非常广泛,是工业生产中重要的化工原料.在1921年我国科学家侯德榜创造了一种著名的纯碱生产方法﹣﹣“联合制碱法”.“联合制碱法”生产过程:
(1)第一步主要反应为NH3+CO2+H2O═NH4HCO3 该反应属于 反应基本反应类型.
(2)第二步用食盐与NH4HCO3反应.食盐来源于某盐田,该粗盐主要含有氯化钠,此外还含有少量硫酸钠,氯化钙和氯化镁.经净化、精制得到生产碳酸钠所需要的食盐水,其主要流程如图1:
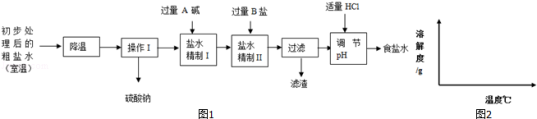
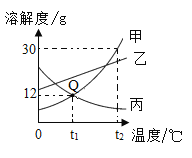
①通过降温使硫酸钠从粗盐水中析出,其原理是氯化钠和硫酸钠的溶解度与温度的变化差异较大,请在溶解度图(如图2)中简单画出氯化钠和硫酸钠的溶解度曲线变化趋势图.
②“精制I”操作中,加入过量含钙元素的碱的化学式是 .
其反应化学方程示为 .
③“精制II”操作中,加入B盐的有关反应方程式为 .
④为保证“精制II”操作中过量B盐把杂质全部除去,请在下表中写出检验溶液中B盐是否过量的实验报告.
实验操作 | 实验现象 | 实验结论 |
⑤查阅资料得知NaCl、NH4HCO3、NaHCO3、NH4Cl在30℃时的溶解度如下表所示:
温度 | NH4Cl | NH4HCO3 | NaHCO3 | NaCl |
30℃ | 41.1g | 27.0g | 11.1g | 36.3g |
请根据溶解度表所提供的信息,写出“联合制碱法”中的第二步属于复分解反应的化学方程式: .
(3)第三步处理制得碳酸钠,反应原理为2NaHCO3![]() Na2CO3+H2O+CO2↑
Na2CO3+H2O+CO2↑