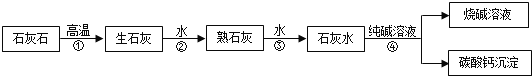
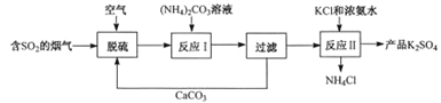
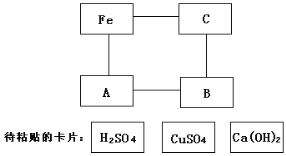
题目内容
【题目】四氧化三铁可用于医疗器械、电子等工业。某实验兴趣小组从工厂采集废液(含FeSO4和少量ZnSO4、MgSO4),进行四氧化三铁的制备实验。
【阅读资料】
(1)25℃时,去氧化物沉淀的pH范围如下表。
Zn(OH)2 | Fe(OH)2 | Mg(OH)2 | |
开始沉淀的pH | 5.7 | 7.6 | 10.4 |
沉淀完全的pH | 8.0 | 9.6 | 12.4 |
(2)25℃时,Zn(OH)2可溶于pH>10.5的碱溶液。
(3)制备Fe3O4的实验流程如下:
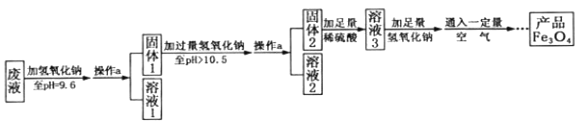
【回答问题】
(1)往废液中加入氢氧化钠溶液生成沉淀的化学方程式为 (写一个即可)。
(2)操作a的名称为 。该操作需要的玻璃仪器有烧杯、玻璃棒、 等。玻璃棒在此操作中的主要作用是 。
(3)溶液1所含溶质有 (至少写两种);溶液3所含溶质的主要成分为 。
(4)该实验取废液100g,最终得到产品四氧化三铁质量为3.48g,则原废液中硫酸亚铁溶质的质量分数不低于 (精确到0.01%)。
【答案】(1)2NaOH+ ZnSO4= Zn(OH)2↓ +Na2SO4或2 NaOH+ FeSO4= Fe(OH)2↓ +Na2SO4
(2)过滤、漏斗、引流(搅拌)
(3)硫酸镁、硫酸钠、氢氧化钠、氢氧化镁(两种即可)、硫酸亚铁
(4)6.84%
【解析】(1)第一步加氢氧化钠至PH=9.6,结合阅读资料可知会生成两种沉淀。它们分别是Zn(OH)2和Fe(OH)2,并且二者全部沉淀。可写2 NaOH+ ZnSO4= Zn(OH)2↓ +Na2SO4或2 NaOH+ FeSO4= Fe(OH)2↓ +Na2SO4
(2)操作a将反应后的物质分成了固体和液体,所以该操作为过滤。过滤需要漏斗。玻璃棒的作用主要是引流,以防液体溅出造成不必要的事故。
(3)因第一步加氢氧化钠至PH=9.6,Zn(OH)2和Fe(OH)2二者全部沉淀,生成硫酸钠。氢氧化钠过量,结合资料可知未产生氢氧化镁沉淀,即有硫酸镁和氢气体镁。
由1可知:固体1为Zn(OH)2和Fe(OH)2。即第二步加氢氧化钠至PH大于10.5,固体2应为Fe(OH)2。固体2与稀硫酸反应后生成溶液3,所以溶液3的成分应为硫酸亚铁。
(4)可根据化学式进行计算:3.48g四氧化三铁含铁元素的质量为;![]() =2.52g
=2.52g
则硫酸亚铁的质量为:![]() = 6.84g
= 6.84g
废液中硫酸亚铁的质量分数为![]() =6.84%
=6.84%