题目内容
【题目】在工业上用纯碱和石灰石为原料制备烧碱,主要流程如图所示:
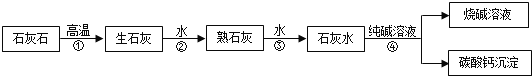
(1)在①-④四个过程中,发生了分解反应的是 (填序号).
(2)检验烧碱溶液中含有少量Na2CO3的具体方法是.
(3)在室温下,将53g质量分数为10%的Na2CO3溶液与3000g澄清石灰水充分混合,恰好完全反应.则这时所得NaOH溶液的质量是多少?(计算结果精确至0.1g)
【答案】(1)①
(2)取适量溶液于试管中,滴加稀盐酸,若有气泡产生,则说明含有碳酸钠
(3)3048.0g
【解析】
试题分析:(1)碳酸钙在高温下生成氧化钙和二氧化碳,属于分解反应;氧化钙和水反应生成氢氧化钙,属于化合反应;氢氧化钙和碳酸钠反应生成碳酸钙和氢氧化钠,属于复分解反应;故填:①;
(2)因Na2CO3能与稀盐酸反应产生二氧化碳气体,在溶液中有气泡冒出,现象明显,可选稀盐酸,具体操作为:取适量溶液于试管中,滴加稀盐酸,若有气泡产生,则说明含有碳酸钠;故答案为:取适量溶液于试管中,滴加稀盐酸,若有气泡产生,则说明含有碳酸钠;

【题目】四氧化三铁可用于医疗器械、电子等工业。某实验兴趣小组从工厂采集废液(含FeSO4和少量ZnSO4、MgSO4),进行四氧化三铁的制备实验。
【阅读资料】
(1)25℃时,去氧化物沉淀的pH范围如下表。
Zn(OH)2 | Fe(OH)2 | Mg(OH)2 | |
开始沉淀的pH | 5.7 | 7.6 | 10.4 |
沉淀完全的pH | 8.0 | 9.6 | 12.4 |
(2)25℃时,Zn(OH)2可溶于pH>10.5的碱溶液。
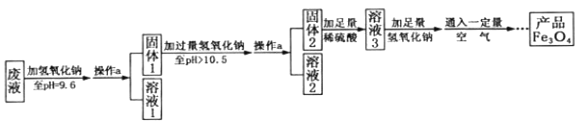
(3)制备Fe3O4的实验流程如下:
【回答问题】
(1)往废液中加入氢氧化钠溶液生成沉淀的化学方程式为 (写一个即可)。
(2)操作a的名称为 。该操作需要的玻璃仪器有烧杯、玻璃棒、 等。玻璃棒在此操作中的主要作用是 。
(3)溶液1所含溶质有 (至少写两种);溶液3所含溶质的主要成分为 。
(4)该实验取废液100g,最终得到产品四氧化三铁质量为3.48g,则原废液中硫酸亚铁溶质的质量分数不低于 (精确到0.01%)。