��Ŀ����
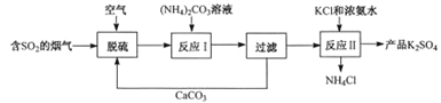
����Ŀ��ij�ȵ糧������õ���ʯ�ࣨCaSO42H2O������K2SO4���ϵ��������£�
��ش��������⣺
��1��ʯ����S�Ļ��ϼ��� ��������̵Ļ�ѧ����ʽΪ2CaCO3+2SO2+O2+4H2O=2CaSO42H2O+2 ��
��2��ʯ���뱥�ͣ�NH4��2CO3��Һ���ϣ�������Ӧ��ʱ�費�Ͻ��裬��Ŀ���� ��
��3��ʵ������ɹ��˲�������Ҫ������������̨���������Լ� ������ĸ��������������������� ��

��4����NH4��2SO4��KCl��Һ����Ũ��ˮ�з�����Ӧ������K2SO4���壮�˷�Ӧ�Ļ��������� ��Ũ��ˮ�������� ����Ӧ�������ܱ������н��е�ԭ���� ��
��5���ù��տ���ѭ�����õ������� ��дһ����������ƷNH4Cl��NaOH��Һ����ȣ�������������ʹʪ��ĺ�ɫʯ����ֽ�� ɫ��
���𰸡���1��+6 CO2
��2��ʹԭ�ϳ�ַ�Ӧ�����ԭ��������
��3��ac ����
��4�����ֽⷴӦ ��������ص��ܽ�ȣ���������ص�������Ũ��ˮ�ӷ�
��5��̼��� ��
��������
�����������1����CaSO42H2O�У����ڸ���+2�ۡ����ԩ�2�ۡ�����+1�ۣ����ԣ�����+6�ۣ��������غ㶨�ɷ�Ӧǰ��ԭ�ӵ����༰��Ŀ�����֪��Ӧ�����������CO2��
��2��ʯ���뱥�ͣ�NH4��2CO3��Һ���ϣ�������Ӧ��ʱ�費�Ͻ��裬��Ŀ����ʹԭ�ϳ�ַ�Ӧ�����ԭ�������ʣ�
��3��ʵ������ɹ��˲�������Ҫ������������̨���������Լ��ձ���©������������������������
��4����NH4��2SO4��KCl��Һ����Ũ��ˮ�з�����Ӧ������K2SO4���壬�������Ȼ�泥������ֻ�����������˳ɷ��������������ֻ�������ڸ��ֽⷴӦ������Ũ��ˮ�ӷ������������˴������ȣ���������ص��ܽ�ȣ���������ص�������Ϊ�˷�ֹ�����ӷ�����Ӧ�������ܱ������н��У�
��5���ɷ�Ӧ�����̿�֪���ù��տ���ѭ�����õ�������̼��ƣ�����NH4Cl��NaOH��Һ����ȣ������˰�����������ˮ��Һ�Լ��ԣ���ʹʪ��ĺ�ɫʯ����ֽ����ɫ��

����Ŀ������������������ҽ����е�����ӵȹ�ҵ��ijʵ����ȤС��ӹ����ɼ���Һ����FeSO4������ZnSO4��MgSO4���������������������Ʊ�ʵ�顣
���Ķ����ϡ�
��1��25��ʱ��ȥ�����������pH��Χ��������
Zn��OH��2 | Fe��OH��2 | Mg��OH��2 | |
��ʼ������pH | 5.7 | 7.6 | 10.4 |
������ȫ��pH | 8.0 | 9.6 | 12.4 |
��2��25��ʱ��Zn��OH��2������pH��10.5�ļ���Һ��
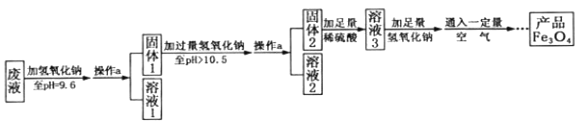
��3���Ʊ�Fe3O4��ʵ���������£�
���ش����⡿
��1������Һ�м�������������Һ���ɳ����Ļ�ѧ����ʽΪ ��дһ����������
��2������a������Ϊ ���ò�����Ҫ�IJ����������ձ����������� �ȡ��������ڴ˲����е���Ҫ������ ��
��3����Һ1���������� ������д����������Һ3�������ʵ���Ҫ�ɷ�Ϊ ��
��4����ʵ��ȡ��Һ100g�����յõ���Ʒ��������������Ϊ3.48g����ԭ��Һ�������������ʵ��������������� ����ȷ��0.01%����