题目内容
某兴趣小组从废铝锅底部剪一块铝片,将它放入20%的稀盐酸中,产生氢气的质量与消耗盐酸的质量如下图(假设酸与氧化膜反应时没有H2产生,其他杂质不与酸反应)。请回答:
(1)从图中看出,该反映产生了H2_______g。
(2)产生氢气的化学方程式为:__________;铝片中铝单质的质量为____。
(1)1.2(2)2Al+6HCl=2AlCl3+3H2↑;10.8g
解析试题分析:废铝锅底部剪一块铝片提示这个不是纯铝片,它的表面已经被氧化,生成了三氧化二铝,所以从图像上可以看出,0-50.0g的盐酸加入后,没有任何氢气冒出,这个阶段就是稀盐酸与氧化铝反应了。后面的曲线表面是铝和稀盐酸反应放出氢气,到250.g时候达到最大值,也就是总共产生氢气最大为1.2g。故这就是第一空的答案。(2)的解答难度也不大,先写出铝金属与稀盐酸反应的方程式,这是个典型的置换反应,方程式为2Al+6HCl=2AlCl3+3H2↑,注意需要系数配平,三氧化二铝与稀盐酸能反应,但不能产生氢气,故不必写方程式,最后根据这个方程利用简单的系数比可以求出金属铝的质量,注意利用氢气的1.2g来列关系式,因为稀盐酸中含有水,不能用250.0g来计算。
解:设原来含有铝单质的质量为xg.
2Al+6HCl=2AlCl3+3H2↑
2*27 3*2
x 1.2g
2*27/x=3*2/1.2
不难解得x=10.8g
答:含有铝单质的质量为10.8g.
考点:化学方程式的计算,利用简单的物质关系比来求成分的质量。
点评:认真审题,找出反应的实质和比例关系。

取10锌粉和铜粉的混合物于烧杯中,向烧杯中分四次加入等质量的同种稀硫酸,实验过程中得到如下数据.
(1)写出实验过程中发生反应的化学方程式: .
(2)混合物中铜粉的质量是 .
(3)计算所用稀硫酸中溶质的质量分数.(保留计算过程)
| | 第1次 | 第2次 | 第3次 | 第4次 |
| 加入稀硫酸的质量 | 20g | 20g | 20g | 20g |
| 剩余固体的质量 | 8.7g | 7.4g | 6.1g | 5.5g |
乙醇俗称酒精,可用作医用消毒,也常作燃料。其完全燃烧的化学方程式可表示为:C2H6O+3O2 2 CO2+ 3 H2O 。
2 CO2+ 3 H2O 。
23g乙醇完全燃烧需消耗多少克氧气?
乙醇不完全燃烧会产生一氧化碳,某实验测得反应前后各物质的质量如下表:
| 物质 | 乙醇 | 氧气 | 二氧化碳 | 水 | 一氧化碳 |
| 反应前质量(g) | 4.6 | 8.8 | 0 | 0 | 0 |
| 反应后质量(g) | 0 | 0 | 6.6 | 5.4 | a |
①表中a的值为____ __。
②该实验发生反应的化学方程式为:4C2H6O+11O2
 _____ CO2+ _____ H2O + _____ CO 。
_____ CO2+ _____ H2O + _____ CO 。 现有溶质质量分数为8%的食盐水40g,要使溶液中氯化钠的质量分数达到20%,以下说法正确的是( )
| A.加入食盐4g | B.蒸发水分20g |
| C.蒸发水分24g | D.加入质量分数为25%的食盐水96g |
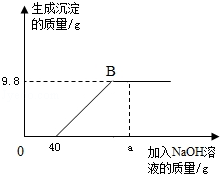
向溶质的质量分数为17%的硝酸银溶液中逐滴滴入稀盐酸,测得滴入盐酸的质量与生成沉淀的质量有如图所示关系,则恰好完全反应时所得溶液中溶质的质量分数为
| A.6.3% | B.7.3% | C.10% | D.17% |
 2H2↑+ O2 ↑)
2H2↑+ O2 ↑)