题目内容
【题目】鸡蛋主要由蛋壳、蛋壳膜、蛋白、蛋黄等几个部分组成,其中蛋壳的主要成分是CaCO3,里面覆盖一层蛋壳膜。化学活动兴趣小组的同学开展了以下探究活动:
(提出问题)蛋壳中的CaCO3含量是多少?
(查阅资料)
a、蛋壳经过科学检测其中含CaCO3的质量分数约为82%~85%,含蛋白质质量分数约14-17%。
b、蛋壳膜中蛋白质含量约为90%~93%。
(设计方案)
方案一:用“灼烧法”,将该蛋壳放在空气中充分灼烧并采集相关数据进行测定。
方案二:用“酸处理法”,将蛋壳与稀盐酸反应进行测量处理。
(进行实验)
方案一:称取12.0 g蛋壳研磨成粉末置于通风橱中,灼烧至质量不再减少,再称量剩余固体的质量为7.16 g。
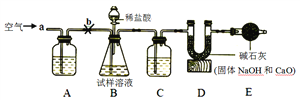
方案二:用如图所示的实验装置,称取12 g蛋壳样品进行实验(假设其他成分均不与HCl反应,装置内试剂均足量。)
(实验步骤)
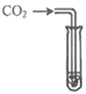
① 按如图连接好装置后,并检查装置的气密性;
②向B装置中加入蛋壳样品后,先通入一会儿空气;
③称量装置D及其中药品的质量;向蛋壳样品中滴入5%的稀盐酸,直到________为止;
④再缓缓通入空气一会儿,至装置D中质量不再增加为止;⑤称量装置D及其中药品的质量。
(数据处理)
方案一:该小组同学认为固体减少为分解产生的二氧化碳质量,据此求出蛋壳中CaCO3的质量分数为91.7%
方案二:测得反应后D装置及其中药品的总质量增加了4.4g,样品中碳酸钙的质量分数是多少________? (写出计算过程,计算结果精确到0.1%)
(评价反思)
(1)方案一:发生分解反应的化学方程式为________,测定值与科学检测的数据有较大误差,主要原因是________。
(2)方案二:装置A中的化学方程式为________,如装置C中的药品为浓硫酸,其作用是________,装置E的作用是________。
【答案】 不再产生气泡 83.3% CaCO3![]() CaO+CO2↑ 蛋壳及蛋壳膜中的有机物灼烧也产生二氧化碳等气体导致测定结果偏高 CO2 +2NaOH= Na2CO3+H2O 干燥气体,除去水蒸气 防止空气中的二氧化碳和水蒸气进入装置D,影响测定结果
CaO+CO2↑ 蛋壳及蛋壳膜中的有机物灼烧也产生二氧化碳等气体导致测定结果偏高 CO2 +2NaOH= Na2CO3+H2O 干燥气体,除去水蒸气 防止空气中的二氧化碳和水蒸气进入装置D,影响测定结果
【解析】本题通过实验探究物质的组成成分考查了常见气体的检验与除杂方法,盐的化学性质,根据化学方程式计算。
实验步骤:③准确测量二氧化碳的质量是实验结果准确的基础,样品中碳酸钙完全反应是准确测量二氧化碳前提,向蛋壳样品中滴入5%的盐酸,直到不产生气泡为止,此时碳酸钙已经完全反应;
数据处理:设:生成4.4g二氧化碳需碳酸钙的质量为x。
CaCO3 + 2HCl == CaCl2 + H2O + CO2↑
100 44
X 4.4g
![]() x=10g;
x=10g;
碳酸钙的质量分数=![]() ×100%=83.3%;
×100%=83.3%;
评价反思:(1)碳酸钙在高温条件下分解生成氧化钙和二氧化碳,化学方程式为:CaCO3![]() CaO+CO2↑;蛋壳及蛋壳膜中的有机物灼烧也产生二氧化碳等气体导致测定结果偏高;
CaO+CO2↑;蛋壳及蛋壳膜中的有机物灼烧也产生二氧化碳等气体导致测定结果偏高;
(2)装置A中的氢氧化钠与空气中的二氧化碳反应生成碳酸钠和水,化学方程式是:CO2 +2NaOH= Na2CO3+H2O;浓硫酸具有吸水性。如装置C中的药品为浓硫酸,其作用是干燥气体,除去水蒸气,D装置中的碱石灰能吸收空气中水和二氧化碳,装置E的作用是防止空气中的二氧化碳和水蒸气进入装置D,影响测定结果。

【题目】某化学课堂围绕“酸碱中和反应”,将学生分成若干小组开展探究活动。请你和他们一起完成以下实验探究。
【演示实验】将一定量稀盐酸加入到盛氢氧化钙溶液的小烧杯中。该反应的化学方程式是_____________。
【查阅资料】CaC12 滚液显中性
【提出问题】实验中未观察到明显现象,部分同学产生了疑问:反应后溶液中溶质的成分是什么?
【猜想与假设】针对疑问,甲组同学猜想如下:
猜想I:只有CaC12 猜想II:有__________
猜想III:有CaC12和Ca(OH)2 猜想IV:有CaCl2、HCl和Ca(OH)2
乙组同学对以上猜想提出质疑,认为猜想IV不合理,其理由是_________________。
【实验探究】为了验证其余猜想,各小组进行了下列三个方案的探究。
实验方案 | 滴加紫色石蕊溶液 | 通入CO2 | 滴加Na2CO3溶液 |
实验操作 |
|
|
|
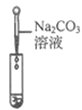
实验现象 | ____________ | __________ | 产生白色沉淀 |
实验结论 | 溶液中含有Ca(OH)2 | 溶液中含有Ca(OH)2 | 溶液中含有Ca(OH)2 |
【得出结论】通过探究,全班同学一致确定猜想III是正确的。
【评价反思】(1)丙组同学认为滴加Na2CO3溶液产生白色沉淀,并不能证明溶液中一定含有Ca(OH)2,请你帮助他们说明原因____________。
(2)在分析反应后所得溶液中溶质的成分时,除了考虑生成物外.还需要考虑_______。
【题目】下列实验目的、操作、现象、结论都正确的是
选项 | 实验目的 | 实验操作 | 实验现象 | 实验结论 |
A | 测溶液pH | 用玻璃棒蘸取待测液滴在用蒸馏水润湿的pH试纸上 | 试纸变为浅红色 | 溶液pH为2 |
B | 鉴别NaOH和NH4NO3 | 在装有等量水的试管中分别加入a、b固体 | 加a的试管水温升高,加b的试管水温降低 | a是NaOH b是NH4NO3 |
C | 验证燃烧是否需要O2 |
| 前者不燃烧,后者燃烧 | 燃烧需要O2 |
D | 比较Al、Cu的活泼性 | 将未经打磨的Al条放入CuSO4溶液中 | 无明显现象 | 活泼性Al<Cu |
A. A B. B C. C D. D