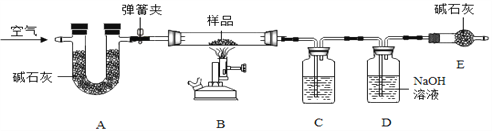
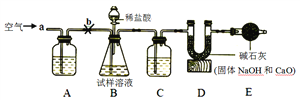
题目内容
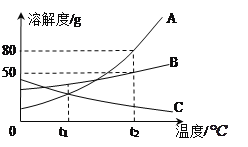
【题目】如图是甲、乙、丙三种物质的溶解度曲线,下列说法错误的是
A. 将t2℃甲、乙、丙三种物质的饱和溶液降温至t1℃,所得溶液溶质质量分数由大到小的顺序是乙>甲>丙
B. 要从甲物质的饱和溶液中获得晶体甲,可采用降温结晶的方法
C. 将丙物质的饱和溶液转化为不饱和溶液可以采用加水或降温的方法
D. t2℃时,将30g甲物质加入到50g水中不断搅拌,形成的溶液中溶质的质量分数是37.5%
【答案】D
【解析】A、甲、乙的溶解度随温度降低而减小,丙的溶解度随温度的降低而增大,分别将三种物质的饱和溶液从t2℃降至t1℃时,甲、乙析出晶体,依然是饱和溶液,此时乙的溶解度大于甲,丙变为不饱和溶液,溶质的质量分数与降温前相等,t1℃时甲的溶解度大于t2℃时丙的溶解度,根据饱和溶液中溶质的质量分数的计算式![]() ×100%可知:降温后所得溶液溶质质量分数大小关系是乙>甲>丙,正确;B、甲的溶解度受温度的影响较大。要从甲的饱和溶液中获得晶体甲,可采用降温结晶的方法正确,正确;C、丙的溶解度随温度的升高而减少。将丙的饱和溶液转化为不饱和溶液可以采用加水或降温的方法,正确;D、t2℃时,甲的溶解度为50g,将30g甲加入到50g水中不断搅拌,只能溶解25g。形成的溶液中溶质的质量分数=
×100%可知:降温后所得溶液溶质质量分数大小关系是乙>甲>丙,正确;B、甲的溶解度受温度的影响较大。要从甲的饱和溶液中获得晶体甲,可采用降温结晶的方法正确,正确;C、丙的溶解度随温度的升高而减少。将丙的饱和溶液转化为不饱和溶液可以采用加水或降温的方法,正确;D、t2℃时,甲的溶解度为50g,将30g甲加入到50g水中不断搅拌,只能溶解25g。形成的溶液中溶质的质量分数=![]() ×100%≈33.3%,错误。故选D。
×100%≈33.3%,错误。故选D。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目