题目内容
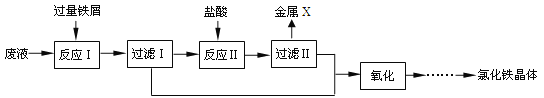
【题目】(9分)废铁屑的主要成份是铁,同时还有少量铁锈(Fe2O3),动物饲料硫酸亚铁的生产工艺之一如下图所示:
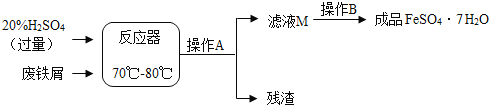
(1)在反应器中发生反应的化学方程式除Fe2(SO4)3+Fe=3FeSO4外还有:,;
(2)滤液M中肯定含有的溶质的化学式是 、 ;
(3)在实验室中完成操作A的玻璃仪器有玻璃棒、烧杯和 ;
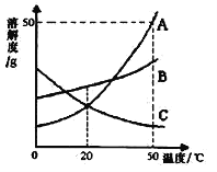
(4)滤液M经过操作B可得硫酸亚铁晶体(FeSO4·7H2O)。已知硫酸亚铁的溶解度和析出晶体的组成如下表:
温度/℃ | 0 | 10 | 30 | 40 | 50 | 60 | 64 | 70 | 80 | 90 | |
溶解度/g | 15.6 | 20.5 | 33.0 | 40.4 | 48.8 | 55.0 | 55.3 | 50.6 | 43.7 | 37.2 | |
析出晶体 | FeSO4·7H2O | FeSO4·4H2O | FeSO4·H2O | ||||||||
根据溶解度表,硫酸亚铁晶体(FeSO4·7H2O)冷却结晶温度最高不超过 ℃;
(5)在化学反应中,若有元素化合价变化的反应定义为氧化还原反应。下列反应类型肯定是氧化还原反应的是 (填字母编号)。
A.化合反应 B.置换反应 C.分解反应 D.复分解反应
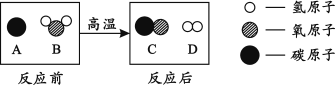
硫酸亚铁晶体加强热会发生反应2FeSO4·7H2O 高温 Fe2O3+SO2+X+14H2O其生成物X的化学式
,该反应 (填“是”或“不是”)氧化还原反应。
【答案】(1)Fe + H2SO4 === FeSO4 + H2↑ Fe2O3+3H2SO4==Fe2(SO4)3+3H2O
(2)H2SO4、FeSO4 (3)漏斗 (4)64 (5)B SO3 是
【解析】
试题分析:(1)废铁屑的主要成份是铁,同时还有少量铁锈(Fe2O3),所以加入过量的稀硫酸,发生的反应化学方程式有:Fe + H2SO4 === FeSO4 + H2↑ ,Fe2O3+3H2SO4==Fe2(SO4)3+3H2O
(2)滤液M中肯定含有的溶质除了生成的FeSO4,还有过量的H2SO4
(3)操作A是将滤液和滤渣分离,是过滤操作,所以需要玻璃仪器有玻璃棒、烧杯和漏斗
(4)根据溶解度表,硫酸亚铁晶体(FeSO4·7H2O)冷却结晶温度最高不超过64
(5)在化学反应中,若有元素化合价变化的反应定义为氧化还原反应,而置换反应前后都会出现单质,根据化合价的规律:在单质中元素的化合价为0,即一定有化合价的变化,所以置换反应肯定是氧化还原反应,故选B,根据质量守恒定律的微观解释,结合反应2FeSO4·7H2O 高温 Fe2O3+SO2+X+14H2O,可推出生成物X的化学式为SO3,应为反应前FeSO4中铁的化合价为+2,而Fe2O3中铁的化合价为+3,有化合价的变化,属于氧化还原反应