题目内容
【题目】(5分)能源、环境与人类的生活和社会发展密切相关。
(1)目前,人类以化石燃料为主要能源。常见的化石燃料包括煤、石油和 。
(2)为减少污染、提高煤的利用率,可将其转化为可燃性气体,此过程可认为是碳与水的反应,其微观示意图如下所示:
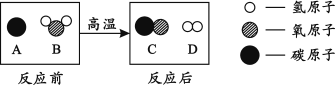
① 该反应的化学方程式为 。
② 该反应生成物的分子个数比为 。
(3)为减少温室气体排放,人们积极寻找不含碳元素的燃料。经研究发现NH3燃烧的产物没有污染,且释放大量能量,有一定应用前景。
① NH3中氮元素和氢元素的质量比为 。
② 将NH3燃烧反应的化学方程式补充完整:4NH3 + 3O2 点燃 6H2O + 。
【答案】(1)天然气 (2)① C + H2O 高温 CO + H2 ② CO与H2的分子个数比为1∶1
(3)① 14∶3 ② 2N2
【解析】
试题分析:(1)三大化石燃料包括煤、石油和天然气
(2)根据微观示意图,可分别写出各物质的化学式,A为C,B为H2O,C为CO,D为H2,所以① 该反应的化学方程式为:C + H2O 高温 CO + H2,②根据反应的化学方程式,可判断该反应生成物的分子个数比为1∶1
(3)①根据化学式,NH3中氮元素和氢元素的质量比=14×1:1×3=14:3
②根据质量守恒定律的微观解释:化学反应前后,原子的种类,个数都不变,所以不难推出化学方程式补充完整为:4NH3 + 3O2 点燃 6H2O + 2N2

 阅读快车系列答案
阅读快车系列答案【题目】(9分)废铁屑的主要成份是铁,同时还有少量铁锈(Fe2O3),动物饲料硫酸亚铁的生产工艺之一如下图所示:
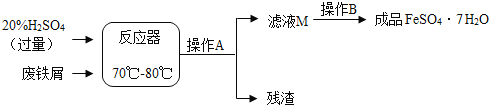
(1)在反应器中发生反应的化学方程式除Fe2(SO4)3+Fe=3FeSO4外还有:,;
(2)滤液M中肯定含有的溶质的化学式是 、 ;
(3)在实验室中完成操作A的玻璃仪器有玻璃棒、烧杯和 ;
(4)滤液M经过操作B可得硫酸亚铁晶体(FeSO4·7H2O)。已知硫酸亚铁的溶解度和析出晶体的组成如下表:
温度/℃ | 0 | 10 | 30 | 40 | 50 | 60 | 64 | 70 | 80 | 90 | |
溶解度/g | 15.6 | 20.5 | 33.0 | 40.4 | 48.8 | 55.0 | 55.3 | 50.6 | 43.7 | 37.2 | |
析出晶体 | FeSO4·7H2O | FeSO4·4H2O | FeSO4·H2O | ||||||||
根据溶解度表,硫酸亚铁晶体(FeSO4·7H2O)冷却结晶温度最高不超过 ℃;
(5)在化学反应中,若有元素化合价变化的反应定义为氧化还原反应。下列反应类型肯定是氧化还原反应的是 (填字母编号)。
A.化合反应 B.置换反应 C.分解反应 D.复分解反应
硫酸亚铁晶体加强热会发生反应2FeSO4·7H2O 高温 Fe2O3+SO2+X+14H2O其生成物X的化学式
,该反应 (填“是”或“不是”)氧化还原反应。
【题目】(5分)a、b、c、d是初中化学中常见的4种元素,有关信息如下表所示。A、B、C、D、E是由上述4种元素中的一种或几种组成的纯净物。
元素 | a | b | c | d |
有关 信息 | 其单质A是密度最小的气体 | 地壳中含量最多的元素 | 形成化合物种类最多的元素 | 食盐中含有大量的该金属元素 |
(1)A的化学式是 。
(2) 单质B燃烧时,可生成不同的气体C或D。B充分燃烧生成C的化学方程式是 。
(3)E溶于水放出大量的热,得到溶质质量分数为10%的无色溶液Ⅰ,向Ⅰ中通入足量气体C后得溶液Ⅱ,发生反应的化学方程式是 ;与Ⅰ相比,Ⅱ中 (填序号)。
①溶质质量小 ②溶剂质量小 ③溶液质量大 ④溶质质量分数大