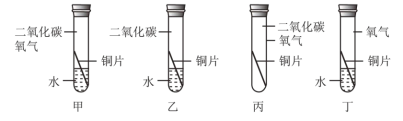
��Ŀ����
����Ŀ���������ƣ�Na2FeO4����һ�ָ�Ч��ܾ�ˮ����������ҵ�ϳ����ô������ƣ�NaClO����������������Ӧԭ���û�ѧ����ʽ��ʾΪ�� 3NaClO+2Fe(NO3)3+10NaOH=2Na2FeO4��+3NaCl+6NaNO3+5H2O
��1���������ƣ�NaClO������Է�������Ϊ__��������Ԫ�صĻ��ϼ�Ϊ__��
��2���������ƣ�Na2FeO4������Ԫ�غ���Ԫ�ص�������Ϊ____�������ȣ���
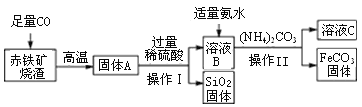
��3����Ҫ�Ƶ�830kg������20%�ĸ������ƣ�������Ҫ�������Ƶ������Ƕ���__________������ʽ���㣩
���𰸡�74.5 +1 7��8 447kg������������̣�
��������
��1����NaClO�У���Ԫ�صĻ��ϼ�Ϊ+1�ۣ���Ԫ�صĻ��ϼ�Ϊ��2�ۣ��裺������������Ԫ�صĻ��ϼ�Ϊx�����ݻ�������Ԫ�ص��������ϼ۵Ĵ�����Ϊ0����+1+x+����2����0�����x��+1������Է�������=23+35.5+16��74.5��
��2���������ƣ�Na2FeO4������Ԫ�غ���Ԫ�ص�����֮��=56����16��4����7��8��
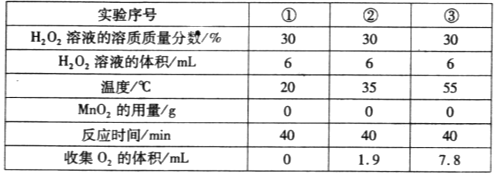
��3��������20%�ĸ��������и������Ƶĺ�����1��20%��80%��
�裺��Ҫ�������Ƶ�����Ϊx��

![]() x��447kg��
x��447kg��

 ����ѧ��Ӯ�����ϵ�д�
����ѧ��Ӯ�����ϵ�д� ѧ���쳵�����ּ��������ҵ�½����������ϵ�д�
ѧ���쳵�����ּ��������ҵ�½����������ϵ�д�����Ŀ��ij��ѧ��ȤС���һ������ĺ�ɫ��ĩ��ɽ���̽����������벢�ش����⡣
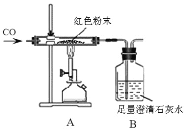
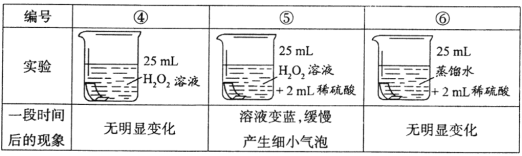
����ʦ���ѣ�����Cu ��Fe2O3���ֹ����е�һ�ֻ�������ɡ�
��������룩��ɫ��ĩ���ܵ���ɣ�
����٣���ɫ��ĩ��Cu�� ����ڣ���ɫ��ĩ��Fe2O3��
����ۣ���ɫ��ĩ��Cu ��Fe2O3�Ļ����
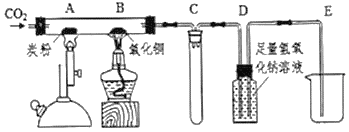
��ʵ��̽����ͬѧ��Ϊȷ����ɫ��ĩ����ɣ���ȡ�÷�ĩ5.0gװ��Ӳ�ʲ������У�������ͼ��ͨ����н���ʵ�顣
��Ӧǰ��������װ�ú����ʵ������������������±���
��Ӧǰ | ��Ӧ�� |
�����ܺͺ�ɫ��ĩ��������Ϊ37.3 g | �����ܺ������ʵ�������Ϊ36.1 g |
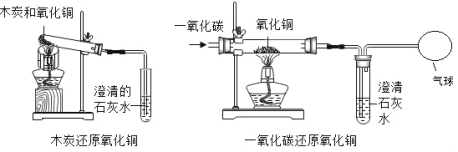
��1��Aװ���з�����Ӧ�Ļ�ѧ����ʽ_______����������Ӧ�ù۲쵽��������_________
��2��С��ͬѧ�����������е����ݺ����ϵó�����_______����١����ڡ����ۡ����϶�����ȷ��������_______________��
��3����ͬѧ��ΪΪ�˷�ֹ�ձ���Һ�嵹������ʵ��ֹͣ����ǰӦ�ȶϿ�A��B�����ӣ���С����Ϊ����Ҫ��������_________________
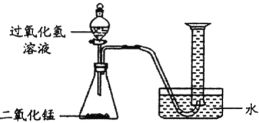
����˼���ۣ���4��ʵ���С������ͬѧָ������ͼװ��δ����β���Ĵ�����������ͬѧ���������ͼװ�ô���ԭװ�ã���Cװ�õ�������___________________�����ٴ����㣩��