题目内容
【题目】过氧化氢在生产生活中有着广泛的应用。化学实验小组对过氧化氢的某些性质进行了研究。
Ⅰ.不稳定性
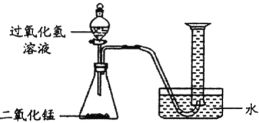
(1)如图所示进行实验(还测量收集的氧气体积),过氧化氢分解的化学方程式为_________________。
(2)能用排水法收集氧气的原因是 _________________________。
(3)已知:常温常压下,氧气的密度为1. 33 g·L–1。实验小组称量了10 g溶质质量分数为 6%的过氧化氢溶液进行实验,如果将该过氧化氢溶液一次性全部放入锥形瓶中,则选择规格为________mL(选填“50”、“200”或“250"”)的量筒收集氧气较为合适。
(4)实验小组同学还探究了温度对过氧化氢分解速率的影响,相关实验数据如下表:
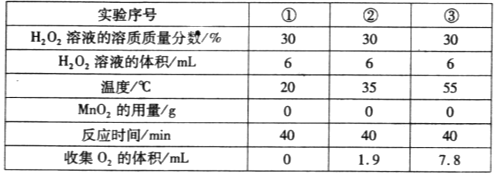
由此得出的结论是_________________________。
Ⅱ.腐蚀性
(查阅资料)H2O2溶液有一定的腐蚀性。
(进行实验)将铜片分别浸泡在以下3种溶液中进行实验,实验现象如下表:
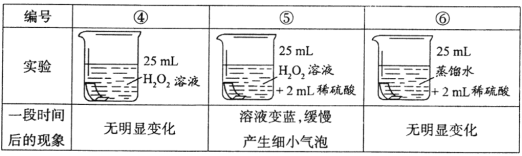
(解释与结论)
(5)实验④的作用是________________。
(6)实验⑤中铜片被腐蚀的反应为Cu + H2O2+ H2SO4=CuSO4+□________,请补全该反应的化学方程式。
(反思交流)
(7)小红同学提出,实验⑤中除发生(6)所给的反应外,还发生了另一个反应导致有细小的气泡产生,该反应的反应物是_______________________。
【答案】2H2O2![]() 2H2O+O2↑ 氧气不易溶于水 250 温度越高,过氧化氢分解的越快 对照实验 2H2O 过氧化氢
2H2O+O2↑ 氧气不易溶于水 250 温度越高,过氧化氢分解的越快 对照实验 2H2O 过氧化氢
【解析】
(1)如图所示进行实验,过氧化氢在二氧化锰做催化剂的条件下生成水和氧气,化学方程式为:2H2O2![]() 2H2O+O2↑;
2H2O+O2↑;
(2)能用排水法收集O2的原因是:氧气不易溶于水;
(3)设生成氧气的质量为x,
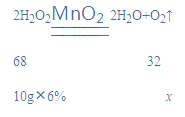
![]()
x=0.282g,
得到氧气的体积=0.282g![]() 1. 33 g·L–1=212mL,应选250mL的量筒;
1. 33 g·L–1=212mL,应选250mL的量筒;
(4)探究温度对过氧化氢分解速率的影响,由表格得出的结论是:温度越高,过氧化氢分解的越快;
(5)实验④的作用是对照实验;
(6)铜片被腐蚀的反应是:铜和过氧化氢和稀硫酸反应生成硫酸铜和水,Cu+H2O2+ H2SO4=CuSO4+2H2O;
(7)过氧化氢在二氧化锰做催化剂的条件下生成水和氧气。

【题目】在一定条件下,在一个密闭容器内发生某反应,测得反应过程中各物质的质量如表所示,下列说法不正确的是( )
物质 | X | Y | Z | W |
反应前质量/g | 10 | 3 | 90 | 0 |
反应后质量/g | 3.2 | 3 | 待测 | 3.2 |
A. W可能是单质 B. Y可能是催化剂
C. 该反应是分解反应 D. 反应后Z物质的质量为![]()