��Ŀ����
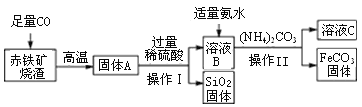
����Ŀ��̼������(FeCO3)��������������ҩ��������ó�������������Ҫ�ɷ�ΪFe2O3��SiO2�ȣ�Ϊԭ���Ʊ�̼����������������ʾ��ͼ��
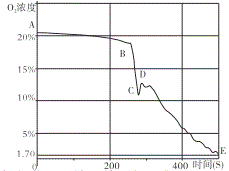
�����ϣ�40������ʱ��(NH4)2CO3�ֽ⡣
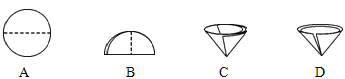
(1)�����������Ϊ_____���ò�������Ҫ��Բ����ֽ�۵�����������ͼʾ�в��ó��ֵ�������_____������ĸ��ţ���
(2)��������������ͨ��CO������Ӧ�Ļ�ѧ����ʽΪ__________��
(3)����(NH4)2CO3�÷�Ӧ������Ƶ�������__________��
(4)��ҺC��һ�����е�Ԫ����__________��
���𰸡����� �������2��D �������3��Fe2O3+3CO ![]() 2Fe+3CO2 ������Һ���¶ȵ���40�� H��O��S��N�����⡢��������
2Fe+3CO2 ������Һ���¶ȵ���40�� H��O��S��N�����⡢��������
��������
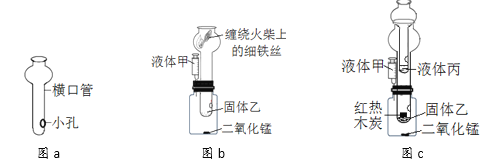
��1�����˿��Խ������Թ������Һ�з�����������Բ����������Ϊ���ˣ�A��B��C ����ֽ����ȷ���۵�������D�е���ֽ���ӿڴ����ַ�϶��Һ���ֱ�ӵĽ���������ձ������Բ��ó��ֵ�������D��
��2��һ����̼���������ڸ��µ��������������Ͷ�����̼����ѧ����ʽΪ��Fe2O3+3CO![]() 2Fe+3CO2��
2Fe+3CO2��
��3���������С����ϡ��ṩ����Ϣ��֪��40������ʱ����NH4��2CO3�ֽ⣬���Լ��루NH4��2CO3�÷�Ӧ������Ƶ������ǣ�������Һ���¶ȵ���40�棻
��4������������̼��立�Ӧ����̼������������泥�������ҺC��һ�����е�Ԫ����H��O��S��N�����⡢����������

 ���Ǽ���С����ϵ�д�
���Ǽ���С����ϵ�д� �Ͻ�ƽ���Ȿϵ�д�
�Ͻ�ƽ���Ȿϵ�д�����Ŀ��ij��ѧ��ȤС����̽������ȼ������ʱ����������ʵ�飺
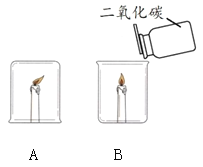
ͬѧ�Ƿ�����֧����Ϩ���ˡ�
��������⣩ʵ��A������Ϩ���ԭ����ʲô��
����������裩
����1���ձ��ڵ��������ľ�����������Ϩ��
����2���ձ��ڵĶ�����̼�������ߣ���������Ϩ��
������ʵ�飩
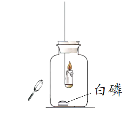
ʵ��I����ȼ��������������������Ϩ����÷Ŵ�������ס��۲쵽����ȼ�ա�
ʵ��II������⣬ʵ��A�У�����Ϩ��ʱ���ձ��ڶ�����̼���������ԼΪ3%���ڼ���ƿ�а���һ����������ռ����壬�ֱ����ȼ�յ������ȼ�յĺ��ף�ʵ���¼���£�
V��O2����V��CO2�� | ���� | ���� |
1:4 | ȼ�� | ȼ�� |
1:5 | ȼ�� | ȼ�� |
1:6 | Ϩ�� | ȼ�� |
1:9 | Ϩ�� | ȼ�� |
����������ۣ�
��1��ʵ��B������Ϩ�����ֶ�����̼�Ļ�ѧ������_______��
��2��ʵ��I��Ŀ����_______��
��3��д������ȼ�յĻ�ѧ����ʽ_______��
��4��ʵ��II֤������2�������ݵ�ʵ��������_______��
��5�����ʵ��I��ʵ��II���ó���ʵ�������_______��
��ʵ�鷴˼��
��6��ͨ����ʵ�飬ͬѧ�Ƕ�����ȼ�յ����������µ���ʶ����_______��