题目内容
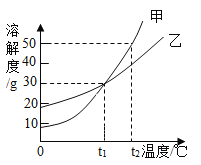
【题目】实验室有铁粉和铜粉的固体混合物,现取10g置于烧杯中,向烧杯中加入一定溶质质量分数的稀硫酸,烧杯内固体质量与加入稀硫酸的质量关系如图所示,请完成下列问题:
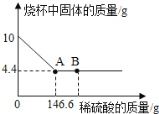
(1)固体样品中铜的质量为_____g。
(2)求恰好完全反应时所得溶液中溶质的质量分数_____。
(3)B点溶液中的溶质是_____。
【答案】4.4 10% FeSO4、H2SO4
【解析】
(1)根据图示分析,10g固体样品加入过量的稀硫酸中,剩余固体质量为4.4g,已知铁溶于硫酸,铜不溶,则样品中铜的质量为4.4g。
(2)解:设恰好完全反应时所得溶液中溶质硫酸亚铁的质量为X,生成氢气的质量为Y。
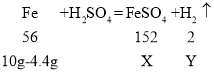
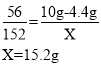
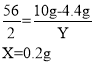
恰好完全反应时所得溶液中溶质的质量分数为:![]()
答:恰好完全反应时所得溶液中溶质的质量分数为10%。
(3)由图示可知,B点铁与硫酸已反应完,且硫酸过量,则溶液中的溶质有生成的FeSO4和过量的H2SO4。

练习册系列答案
相关题目