题目内容
【题目】黄铜片是铜锌合金。化学兴趣小组为了测定黄铜中铜的含量,做如下实验:

反应①结束后,所加稀硫酸刚好反应了一半,反应②恰好完全反应。请回答下列问题:
(1)发生反应的化学方程式为_____;
(2)根据已知条件列出求解黄铜中参加反应①的物质的质量(x)的比例式_____;
(3)该黄铜中铜的含量_____;
(4)反应②结束后,向所得溶液加入87.4g水,所得溶液中溶质的质量分数是_____;
(5)若用含杂质为32.5%的辉铜矿100t来冶炼黄铜,假设在冶炼的过程中铜的损失率为20%,则可冶炼上述黄铜的质量为_____。
【答案】![]()
![]() 67.5% 16.1% 64t
67.5% 16.1% 64t
【解析】
(1)反应①中,锌和稀硫酸反应生成硫酸锌和氢气,反应的化学方程式为:Zn+H2SO4═ZnSO4+H2↑。
故填:Zn+H2SO4═ZnSO4+H2↑。
(2)解:反应①生成氢气质量:20g+100g-119.8g=0.2g,
设参加反应的锌质量为x,生成硫酸锌的质量为y
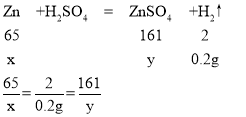
x=6.5g y=16.1g
故填:![]() 。
。
(3)该黄铜中铜的含量为:![]()
答:该黄铜中铜的含量为67.5%。
故填:67.5%。
(4)根据反应①结束后,所加稀硫酸刚好反应了一半,反应②恰好完全反应;
根据(2)可知反应①生成硫酸锌的质量为16.1g,故所得溶液中硫酸锌的质量为:16.1g×2=32.2g;
同时反应②消耗锌的质量与反应①都是6.5g,同时生成氢气0.2g,反应后所得溶液质量为:6.5g×2+100g-0.2g×2=112.6g;
反应②结束后,向所得溶液加入87.4g水,所得溶液中溶质的质量分数是:![]() 。
。
答:所得溶液中溶质的质量分数是16.1%。
故填:16.1%。
(5)含杂质为32.5%的辉铜矿(Cu2S)100t中含有铜元素的质量为:100t×(1-32.5%)×![]() =54t;
=54t;
假设在冶炼的过程中铜的损失率为20%,则可冶炼上述黄铜的质量为:![]() =64t
=64t
答:可冶炼上述黄铜的质量为64t。
答:64t。

 阅读快车系列答案
阅读快车系列答案