��Ŀ����
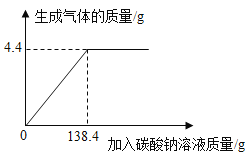
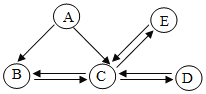
����Ŀ��A��E�dz��л�ѧ�г�����5�������Ҷ�����һ����ͬԪ�ء�B���ж����壬��ɫ����E��ˮ�е��ܽ��С��0.01g��20�棩������֮���ת����ϵ��ͼ��ʾ������������ʾ���˵������ܷ�����ѧ��Ӧ����������ʾ���ʼ���һ�������´���ת����ϵ���������ʵķ�Ӧ��������ȥ����
(1)д����صĻ�ѧ����ʽ����A+C��_____����C��E��_____��
(2)����C�л�����������Bʱ���ɽ������ͨ��_____��ȥ����B��
(3)д�������£�����C�����������ƣ�Na2O2����Ӧ����̼���ƺ������Ļ�ѧ����ʽ_____��
��Դ�ͻ������������Ϊ���ǹ�ע�Ľ��㡣
(4)�����Ļ�ʯȼ����ú��______����Ȼ���ȡ���Ȼ������Ҫ�ɷ���CH4���ڿ�������ȫȼ�յĻ�ѧ����ʽ��____________________________________��
(5)ȼú��Ӱ�컷�������л���������ȼúû��ֱ�ӹ�ϵ����______������ţ���ͬ����
A ���� B ����ЧӦ C �������ƻ� D ���������������
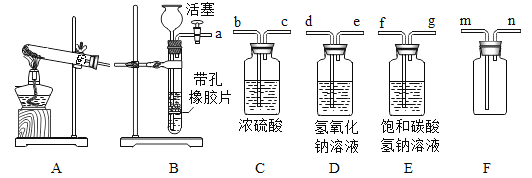
(6)CO2�����������ߣ�ʹȫ�����������������ء���ͼΪCO2�����һ�֡�̼ת������
![]()
����������������������______��
A CaCO3 B C2H5OH C CO
��CO2��H2�ڴ����ͼ��������£�����ת��Ϊ����ԭ����ϩ��C2H4�����뽫�÷�Ӧ�Ļ�ѧ����ʽ����������2CO2+ 6H2  C2H4+_______________��
C2H4+_______________��
�۽�CO2ͨ��Na2CO3��Һ�У�ֻ����NaHCO3���÷�Ӧ�Ļ�ѧ����ʽ��_______��
���𰸡�CO2+C![]() 2CO CO2+Ca��OH��2�TCaCO3��+H2O ���ȵ�����ͭ 2CO2+2Na2O2��2Na2CO3+O2 ʯ�� CH4+O2
2CO CO2+Ca��OH��2�TCaCO3��+H2O ���ȵ�����ͭ 2CO2+2Na2O2��2Na2CO3+O2 ʯ�� CH4+O2![]() CO2+ 2H2O C B 8H2O CO2+ Na2CO3+ H2O��2NaHCO3
CO2+ 2H2O C B 8H2O CO2+ Na2CO3+ H2O��2NaHCO3
��������
B���ж�����һ����̼��һ����̼��C�ת������C�Ƕ�����̼��A�ܷ�Ӧ����һ����̼�������̼����A��̼��������̼����E�ת�����Ұ�ɫ����E��ˮ�е��ܽ��С��0.01g��20�棩����E��̼��ƣ�������̼����D�ת��,��D��̼���ƻ�̼�
��1����A+C��̼�ڸ����������������̼��Ӧ����һ����̼�Ļ�ѧ����ʽ�� CO2+C![]() 2CO����C��E��������̼���������Ʒ�Ӧ����̼��ƺ�ˮ�Ļ�ѧ����ʽ��CO2+Ca(OH)2�TCaCO3��+H2O��
2CO����C��E��������̼���������Ʒ�Ӧ����̼��ƺ�ˮ�Ļ�ѧ����ʽ��CO2+Ca(OH)2�TCaCO3��+H2O��
��2��һ����̼�������ȵ�����ͭ������ԭ��Ӧ����������̼�������ʶ�����̼�л�������һ����̼ʱ���ɽ������ͨ�����ȵ�����ͭ��ȥһ����̼��
��3�������£����ʶ�����̼�����������ƣ�Na2O2����Ӧ����̼���ƺ������Ļ�ѧ����ʽ�� 2CO2+2Na2O2��2Na2CO3+O2��
��4�������Ļ�ʯȼ����ú��ʯ�ͺ���Ȼ���ȡ���Ȼ������Ҫ�ɷ���CH4���ڿ�������ȫȼ�ղ���ˮ�Ͷ�����̼�Ļ�ѧ����ʽ��CH4+O2![]() CO2+ 2H2O��
CO2+ 2H2O��
��5��ȼú��Ӱ�컷�������л���������ȼúû��ֱ�ӹ�ϵ���ǣ�
A��úȼ�ղ����������������γ����ꣻ��ѡ����ȷ�������������⣻
B��úȼ�ղ�������������̼���壬�������ЧӦ����ѡ����ȷ�������������⣻
C���ƻ������������������������úȼ���أ���ѡ������������⣻
D��úȼ�ղ��������̳���ʹ��������������ӣ���ѡ����ȷ�������������⣻
��ѡ��C��
��6��CaCO3 ��C2H5OH�� CO���Ǻ�̼�������CaCO3 ��CO���������������ƣ������ǹ�Ϊ��������л������C2H5OH����ѡB��
��CO2��H2�ڴ����ͼ��������£�����ת��Ϊ����ԭ����ϩ��C2H4�����÷�Ӧ�Ļ�ѧ����ʽ����������2CO2+ 6H2  C2H4+8H2O���÷�Ӧ���������غ㶨�ɣ�������ȷ�Ӧ����2����ԭ�Ӻ�1����ԭ�ӣ�ȱ�ٵ����ʻ�ѧʽΪ��H2O��
C2H4+8H2O���÷�Ӧ���������غ㶨�ɣ�������ȷ�Ӧ����2����ԭ�Ӻ�1����ԭ�ӣ�ȱ�ٵ����ʻ�ѧʽΪ��H2O��
�۹���������̼��̼���ơ�ˮ��ͬ��Ӧ����̼�����ƵĻ�ѧ����ʽ�ǣ�CO2+ Na2CO3+ H2O��2NaHCO3��

����Ŀ����һ������NaOH��Һ������ͨ��CO2���壬��������������ijʵ��С���ͬѧ��������Һ�ɷֽ���������̽��������������ǵ�̽�����������������⣺
��������⣩������Һ�����ʵijɷ���ʲô��
���������ϣ�����һ����CO2����������ͨ��һ������NaOH��Һ�У����ܷ�������������ѧ��Ӧ��
�ȷ�����Ӧ��2NaOH+CO2�TNa2CO3+H2O
��NaOH��Ӧ��ȫ����������Ӧ��Na2CO3+CO2+H2O�T2NaHCO3
�Y�϶���Ca��HCO3��2������ˮ��CaCl2��Һ��NaCl��Һ�������ԣ� NaHCO3��Һ�ʼ��ԣ���ʹ��̪��Һ���ɫ��
����������裩С��ͬѧͨ�����ۣ�������������ֲ���
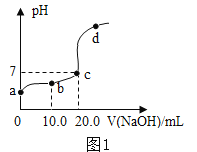
����һ������ΪNaOH��Na2CO3
�����������ȫΪNa2CO3
��1������Ϊ������������Ϊ_____
�����ģ�����ȫΪ NaHCO3
��ʵ��̽����С��ͬѧ��Ʋ����������ʵ�飺
ʵ�鲽�� | ʵ����� | ʵ������ | ʵ����� |
�� | ȡ������Ӧ�����Һ�����Թ� �У��������CaCl2��Һ | �а�ɫ�������� | ��2������_____������ |
�� | ȡ������������Ӧ����ϲ��� Һ���μӼ��η�̪��Һ | ��3������Ϊ_____ | ����������� |
�� | ȡ������������Ӧ����ϲ��� Һ����������ϡHCl | �����ݲ��� | ��4������_____���� |
��ʵ���ܽᣩ�������ʵ�飬ʵ��С���ͬѧ�ܽᲢд��������̽�������еĸ�����Ӧ����ʽ��
��5������Ϊ������������Ӧ�Ļ�ѧ����ʽ��_____��