��Ŀ����
����Ŀ��ijС��ͬѧ����pH��������̼�����ơ�̼���Ƶ�ijЩ���ʽ�������̽����
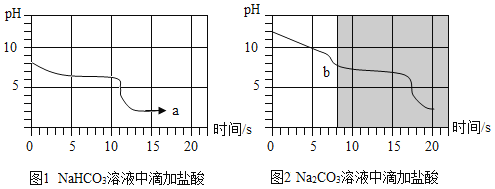
25��ʱ��������������̼ԭ������̼�����ƺ�̼������Һ�У��ֱ���μ�����ͬŨ�ȵ����ᣬ��pH���������pH�仯��ʱ��Ĺ�ϵ��ͼ1��ͼ2��ʾ����ͼ1��ͼ2����Ӱ���ֽ��е��ӣ������������غϡ�
�ش��������⣺
��1������̼ԭ������̼�����ƺ�̼������Һ���ʼ��ԣ�������Һ���Խ�ǿ����_____��
��2��a�������Ϊ_____��b��ǰ������Ӧ�Ļ�ѧ����ʽΪ_____��
��3������ʵ���ȡ����Ϣ���뽫����Na2CO3�� NaHCO3�����ʵ�鷽�������������ֱ�ȡ���ֹ����������ˮ�ܽ⣬��λ�������ϡ���ᣬ_____��
���𰸡�Na2CO3 NaCl��HCl Na2CO3+HCl=NaHCO3+NaCl ����������������Ϊ̼�����ƣ�����ʼ�����ݣ�һ��ʱ��������ݣ���Ϊ̼���ƣ�
��������
��1������pH�仯��ʱ��Ĺ�ϵͼ��֪����Ӧǰ̼��������ҺpHԼΪ8��̼������ҺpHԼΪ12���Լ�����ҺpHԽ�ߣ�����Խǿ��������Һ���Խ�ǿ����̼���ƣ�Na2CO3����Һ��
��2��̼�����������ᷴӦ�����Ȼ��ơ�ˮ�Ͷ�����̼��a��pHԼΪ2������a���������̼�����ƺ����ᷴӦ���ɵ��Ȼ��ƣ�NaCl�������������е��Ȼ��⣨HCl�����������⽫ͼ1��ͼ2����Ӱ���ֽ��е��ӣ������������غϣ�b��ǰ�����ķ�Ӧ��̼���������ᷴӦ����̼�����ƺ��Ȼ��ƣ���ѧ����ʽΪ��Na2CO3+HCl=NaHCO3+NaCl��
��3������ʵ��3��ȡ����Ϣ��֪����̼������Һ�еμ�ϡ����ʱ��ϡ�����Ⱥ�̼���Ʒ�Ӧ����̼�����ƺ��Ȼ��ƣ����̼�����Ʒ�Ӧ�����Ȼ��ơ�ˮ�Ͷ�����̼����˼���Na2CO3��NaHCO3�����ʵ�鷽��Ϊ��ȡ���ֹ����ˮ�����Һ���ֱ���μ������ᣬ����������������Ϊ̼�����ƣ�����ʼ�����ݣ�һ��ʱ��������ݣ���Ϊ̼���ơ�

����Ŀ�����й��ɺ��ܽ��ȷ��һ����( )
A����ѧ��Ӧ�������� | B����ѧ��Ӧ�г����������� |
�ٻ��Ϸ�Ӧ��4P+5O2 �ڷֽⷴӦ��H2CO3 | ��ú��ʯ�͡���Ȼ��һ����ʯȼ�� �ڷ��ӡ�ԭ�ӡ��������������ʵ����ֻ������� |
C���Լ�������ʶ | D����ѧ���������ϵ |
�����������Ͷ�����̼һȼ�ŵ�ľ�� ��Ӳˮ����ˮһ����ˮ | �ٻ�������������������ϵ �ڻ��Ϸ�Ӧ��������Ӧ����������ϵ |
A. AB. BC. CD. D
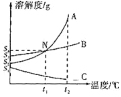
����Ŀ����������ͼ����Ϣ��ѧϰ��һ����Ҫ������������Ȼ��ơ�����ء����������ڲ�ͬ�¶��µ��ܽ�ȡ������ֹ������ʵ��ܽ��������ͼ��ʾ��
�¶�/�� | 20 | 40 | 60 | 80 | |
�ܽ��/g | NaCl | 36.0 | 36.6 | 37.3 | 38.4 |
KNO3 | 31.6 | 63.9 | 110 | 169 | |
Ca��OH��2 | 0.16 | 0.14 | 0.12 | 0.095 | |
����ϸ�Ķ�ͼ����ش��������⣺
��1��A���߱�ʾ����_____���ܽ�����ߡ�
��2����ȥA��������B�������ǣ���ˮ�ܽ⣬����Ũ����_____�����ˣ�ϴ�ӣ����
��3��20��ʱ�����Ȼ��ơ�����ء��������Ƹ�10g�ֱ����ʢ��50gˮ���ձ��У�����ܽ⣬���������Һ�����ʵ����������ֱ�Ϊa%��b%��c%��������֮��Ĵ�С��ϵ��_____��
��4������һ��������Һ����A��B��C���ֱ�����Һ�е�һ�֣��������ʱ���ֻ����������Ɑ������Һ��������_____��