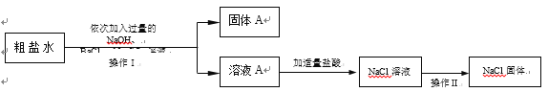
题目内容
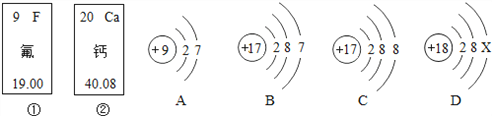
【题目】铝、铁、铜是我们生活中常见的金属.
(1)铝的利用比铜、铁晚是因为金属大规模开发和利用的先后顺序与有关(填字母)_________。
A 金属的活动性 B 金属的导电性 C 金属在底壳中的含量
(2)铝具有很好的抗腐蚀性能,原因是________________。
(3)每年全世界钢铁的产量很高,但钢铁的锈蚀给人类带来了的损失,铁在空气中锈蚀,实际上是铁跟_________和_______ 共同作用的结果;防止铁生锈的方法是______________(写一种);焊接铁制品时,通常先用稀盐酸除去其表面的铁锈,反应的化学方程式为_________。
(4)印发铜制电路板的“腐蚀性”为FeCl3溶液,反应化学方程式分别为①Cu+2 FeCl3=2 FeCl2+CuCl2;②Fe+2 FeCl3=3X.则②中X的化学式为_______。
【答案】A 铝与氧气反应生成了一层致密的氧化物薄膜覆盖在金属铝的表面,隔绝了空气和水 氧气 水 在铁的表面刷漆 ![]()
![]()
【解析】
(1)金属的活动性越强,金属的冶炼越困难,铝的利用比铜、铁晚是因为金属大规模开发和利用的先后顺序与金属的活动性有关,A选项正确,故选A;
(2)铝具有很好的抗腐蚀性能,原因是铝与氧气反应生成了一层致密的氧化物薄膜覆盖在金属铝的表面,隔绝了空气和水,铝不会再被进一步腐蚀;
(3)铁在空气中锈蚀,实际上是铁跟氧气和水共同作用的结果;使铁与这两种物质中的一种或两种隔开来防止铁腐蚀,防止铁生锈的方法是有:在铁的表面刷漆、涂油等;焊接铁制品时,通常先用稀盐酸除去其表面的铁锈,铁锈的主要成分是三氧化二铁,三氧化二铁与稀盐酸反应生成氯化铁和水,反应的化学方程式为![]() ;
;
(4)根据质量守恒定律,反应前后原子的种类和数目保持不变,反应②Fe+2FeCl3=3X中,反应前有3个铁原子,6个氯原子,则反应后3X中有3个铁原子,6个氯原子,则X的化学式为![]() 。
。

 第1卷单元月考期中期末系列答案
第1卷单元月考期中期末系列答案【题目】(1)今天是化学实验室开放日,老师拿出两瓶无标签的试剂,分别是固体和液体,他取少量试剂在试管中混合,立即产生一种无色气体,我们对此气体展开了一系列探究:
①此气体是什么物质?验证它的实验方案如下:
猜想与假设 | 实验步骤 | 现象及结论 |
此气体可能是______ | __________ | ________ |
产生此气体的化学方程式可能是__.
②我想制取该气体,采用的发生装置和收集装置可选取如图甲中的______(填序号)。
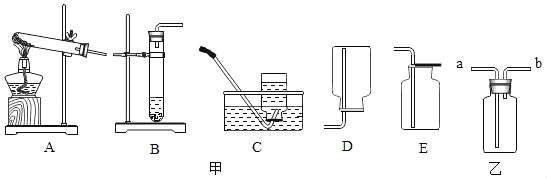
③如图乙装置收集该气体,气体由_________端(填“a”或“b”)导入.
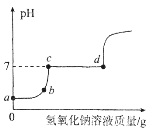
(2)某校化学兴趣小组同学在实验室整理药品时,发现氢氧化钠溶液的试剂瓶未塞瓶塞,且试剂瓶口周围有一些白色固体,他们怀疑氢氧化钠已经变质,于是进行了如下实验探究
(提出问题)氢氧化钠是否变质?
(查阅资料)氯化钠溶液、氯化钡溶液呈中性.
(实验探究)小王、小李两同学分别设计了不同方案并加以实验.
实验操作 | 实验现象 | 实验结论 | |
小王 | 用pH试纸测溶液的pH | 溶液的pH>7 | 说明氢氧化钠溶液没有变质 |
小李 | 取少量溶液于试管中,加入适量氯化钡溶液 | A | 说明氢氧化钠溶液已经变质 |
(1)小李同学认为小王同学的结论不科学,其理由是_________.
(2)小李同学的实验中观察到实验现象A为___________.
(3)小张同学认为该氢氧化钠溶液只是部分变质,于是对小李同学的实验进行如下改进:向试管中加入过量的氯化钡溶液,目的是_________,然后再向溶液中加入__________,通过观察溶液颜色的变化,说明溶液中含有氢氧化钠.
(4)小王同学在测定溶液pH实验中,由于紧张先将pH试纸润湿后再去测氢氧化钠溶液的pH,你认为他测出该溶液的pH会________(填“偏大”“偏小”或“不变”)。