题目内容
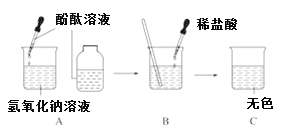
【题目】某同学在实验室发现了一瓶标签残缺的无色溶液﹙如图甲所示﹚,为确认其中的溶质,他设计并进行了如下探究活动,请回答下列问题。
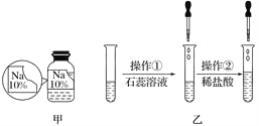
[猜想与假设]溶质可能为NaCl、NaOH、Na2CO3和NaHCO3中的一种。
[资料查阅]上述四种物质的相关信息如下:
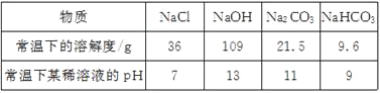
[探究过程]如图乙所示,在操作①后可确定溶质不是NaCl,则其实验现象应是________________________________________________________________________;在进行操作②时有无色无味的气体产生,由此又可排除假设物质中的____________。
[探究结论]你认为该溶液中的溶质可能是上述假设物质中的________,你的判断依据是________________________________________________________________________。
[探究反思](1)若上述探究结论是正确的,操作②产生的气体应是________(写化学式),实验室检验该气体的实验操作及现象是_________________________________________________。
(2)另有同学猜想其中的溶质还可能是Na2SO4,但又没有Na2SO4的上述表列信息.请你根据以上实验操作的相关现象,判断该溶液中的溶质是否是Na2SO4,并叙述理由:____________________________。
【答案】石蕊试液变成蓝色 氢氧化钠 碳酸钠 碳酸氢钠饱和溶液的质量分数不可能达到10%,而碳酸钠溶液可以 CO2 将气体通入石灰水,石灰水变浑浊 若滴加石蕊试液变成蓝色,则不含有硫酸钠
【解析】
[探究过程]氯化钠溶液呈中性,碳酸钠、碳酸氢钠、氢氧化钠都呈碱性,滴入紫色石蕊试液呈蓝色,所以当滴入紫色石蕊呈蓝色时,说明溶质不是氯化钠,当滴入稀盐酸有气泡产生时,说明不是氢氧化钠,故填:石蕊试液变成蓝色 氢氧化钠;
[探究结论]由于溶液的标签上浓度为10%,而饱和碳酸氢钠溶液常温下的溶解度为9.6g,所以碳酸氢钠溶液的溶质质量分数最大为![]() ×100%<10%,所以碳酸钠可以,故填:碳酸钠 碳酸氢钠饱和溶液的质量分数不可能达到10%,而碳酸钠溶液可以;
×100%<10%,所以碳酸钠可以,故填:碳酸钠 碳酸氢钠饱和溶液的质量分数不可能达到10%,而碳酸钠溶液可以;
[探究反思](1)由于碳酸钠能够和稀盐酸反应生成CO2气体,检验该气体方法是将气体通入石灰水,故填:CO2 将气体通入石灰水,石灰水变浑浊;
(2)由于硫酸钠溶液显中性,所以当滴入紫色石蕊试液呈蓝色时,说明不含有硫酸钠,故填:若滴加石蕊试液变成蓝色,则不含有硫酸钠。

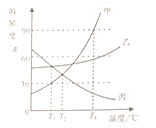
【题目】根据下列溶解度曲线和A物质的部分温度是的溶解度判断下列说法正确的是( )
温度/℃ | 0 | 20 | 40 | 60 | |
溶解度/g | A物质 | 20 | 28 | 45 | 60 |
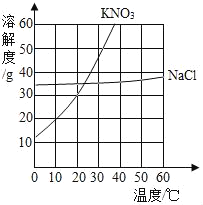
A. 由上图可知,KNO3和NaCl的溶解度均大于A 物质的溶解度
B. 10℃时,将40gNaCl放入50g水中,充分溶解,所得溶液是NaCl的不饱和溶液
C. 将30℃时NaCl、KNO3、和A物质的饱和溶液各降温至10℃,所得溶液的溶质质量分数大小为:KNO3>NaCl>A
D. 20℃时,将KNO3、NaCl和A物质各30g分别配制成恰好饱和溶液,所得溶液的质量大小为A>KNO3=NaCl
【题目】同学们从山上采集到一种石灰石,他们取80克该样品进行煅烧实验(所含杂质在煅烧过程中不发生变化),测得反应后固体的质量(m)与反应时间(t)的关系如下表:
反应时间t∕s | t0 | t1 | t2 | t3 | t4 | t5 | t6 |
反应后固体的质量m∕g | 80 | 75 | 70 | 66 | 62 | 58 | 58 |
请回答下列问题:
(1)当石灰石完全反应后,生成CO2的质量为 g.
(2)求该石灰石中CaCO3的质量分数,写出计算过程.