题目内容
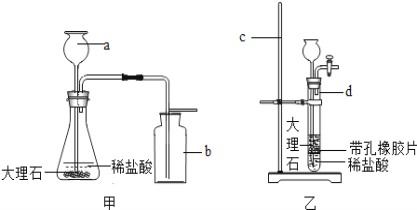
【题目】如图所示,进行中和反应实验:
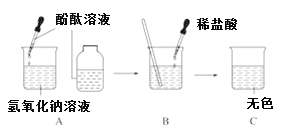
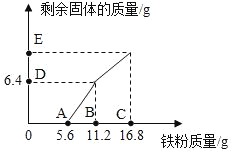
(1)在A的实验中,滴入酚酞溶液后,溶液由无色变为________色。
(2)写出C的溶液中溶质可能存在的几组情况____________________________。(用化学式表示)
(3)若73 g质量分数为20%的盐酸与127 g氢氧化钠溶液恰好完全中和,试计算反应后所得溶液中溶质的质量分数。__________
【答案】红 NaCl或NaCl与HCl 11.7%
【解析】
(1)氢氧化钠溶液呈碱性,能使无色酚酞变成红色,故填:红;
(2)如果氢氧化钠溶液与稀盐酸恰好完全反应,则可知其溶质为NaCl;又因为溶液无色,则氢氧化钠反应完全,可能稀盐酸过量,此时溶质为NaCl和HCl两种,故填:NaCl或NaCl与HCl;
(3)设生成NaCl的质量为x
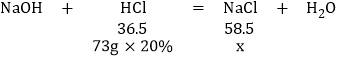
![]()
x=23.4g
NaCl溶液中溶质的质量分数为NaCl%=![]() 。
。

 名校名师培优作业本加核心试卷系列答案
名校名师培优作业本加核心试卷系列答案 全程金卷系列答案
全程金卷系列答案【题目】工业上以高纯度的二氧化锰为原料制备高锰酸钾的主要流程如下:

已知相关物质的溶解度(20℃)如下表:
物质 | K2CO3 | K2SO4 | KMnO4 |
溶解度/g | 111 | 11.1 | 6.34 |
(1)KMnO4中锰元素的化合价为_____.
(2)操作I的名称是_____.“干燥”过程中温度不宜过高的原因是_____(用化学方程式表示).
(3)“通CO2酸化”,反应的化学方程式为:3K2 MnO4+2CO2═2KMnO4+MnO2↓+2K2CO3;不用稀H2SO4酸化,反应的化学方程式为:3K2 MNO4+2H2SO4═2KMnO4+MnO2↓+2K2SO4+2H2O;工业上不采用稀H2SO4酸化的原因是_____.
(4)电解法也可以实现由K2MnO4向KMnO4的转化,反应的化学方程式为:2K2 MnO4+2H2O![]() 2KMnO4+2KOH+H2↑,与“通CO2酸化”相比,其优点是_____.
2KMnO4+2KOH+H2↑,与“通CO2酸化”相比,其优点是_____.