题目内容
【题目】小文同学利用下图实验装置测定某赤铁矿石样品中Fe2O3的质量分数,取l0g样品与足量CO充分反应后,测得剩余固体的质量为7.6g,下列说法正确的是(温馨提示:杂质不参加反应)
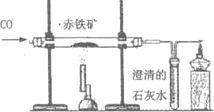
A. 玻璃管中的固体由黑色逐渐变成红色
B. 实验中通入CO的质量为4.2g
C. 生成CO2的质量为2.4g
D. 铁矿石样品中Fe2O3的质量分数为80%
【答案】D
【解析】实验过程中Fe2O3被还原为铁粉,因此,玻璃管中的固体由红色逐渐变成黑色,A错;因样品与足量CO充分反应,所以Fe2O3中O的质量是10g-7.6g=2.4g,Fe2O3的质量为2.4g÷48/160=8g,故铁矿石样品中Fe2O3的质量分数为8g/10g×100%=80%,D正确;根据化学方程式Fe2O3+3CO![]() 2Fe+3CO2,利用Fe2O3的质量可计算出参加反应的CO和生成的CO2的质量分别为4.2g和6.6g,由于一氧化碳有可燃性,为了防止一氧化碳和空气的混合气体遇热发生爆炸,实验开始时应先通一段时间CO,以排除玻璃管内的空气,且实验结束后应继续通CO至装置冷却以防生成的铁在高温下再被氧化,因此实验中通入CO的质量应大于4.2g故B、C均错.
2Fe+3CO2,利用Fe2O3的质量可计算出参加反应的CO和生成的CO2的质量分别为4.2g和6.6g,由于一氧化碳有可燃性,为了防止一氧化碳和空气的混合气体遇热发生爆炸,实验开始时应先通一段时间CO,以排除玻璃管内的空气,且实验结束后应继续通CO至装置冷却以防生成的铁在高温下再被氧化,因此实验中通入CO的质量应大于4.2g故B、C均错.

练习册系列答案
相关题目