题目内容
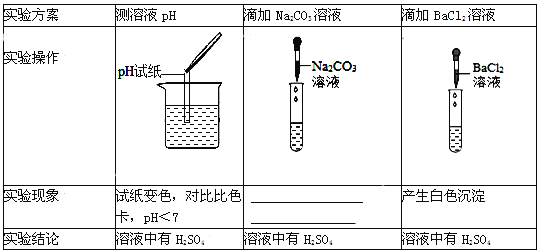
【题目】学习盐的化学性质时,进行了如图所示的实验(提示:氯化钙、氯化钡的溶液都呈中性)

① 碳酸钠是一种重要的盐,甲中碳酸钠溶液中加入酚酞,溶液显______色;乙和丙中都能观察到的实验现象是_______;乙中发生反应的化学方程式是______, 该反应属于_____发应(填基本反应类型);
② 实验结束后,将甲、乙、丙三个实验的废液倒入同一个干净的废液缸中,最终看到废液浑浊并 呈红色;静置,取上层清液于试管中,加入过量氯化钡溶液,有白色沉淀,溶液呈红色。 则废液缸中的废液一定含有指示剂、水、碳酸钙、______; 在分析化学反应后所得物质的成分时,除了考虑生成物外还需考虑____。
【答案】 红 有白色沉淀 Na2CO3+Ca(OH)2=CaCO3↓+2NaOH 复分解反应 NaCl Na2CO3 NaOH 反应物是否有剩余
【解析】本题考查了碱的化学性质,盐的化学性质,化学方程式的书写。在分析化学反应后所得物质的成分时不仅考虑生成物有什么,还需要考虑反应物中什么物质过量问题。
① 碳酸钠溶液呈碱性,酚酞试液遇碱性物质变红色。碳酸钠溶液中加入酚酞,溶液显红色;氢氧化钙与碳酸钠反应生成碳酸钙沉淀和氢氧化钠,氯化钙与碳酸钠反应生成碳酸钙沉淀和氯化钠,乙和丙中都能观察到的实验现象是有白色沉淀;乙中发生反应的化学方程式是Na2CO3+Ca(OH)2=CaCO3↓+2NaOH,该反应是由两种化合物相互交换成分生成另外两化合物,属于复分解反应;
②实验结束后,将甲、乙、丙三个实验的废液倒入同一个干净的废液缸中,最终看到废液浑浊并呈红色,说明了废液呈碱性,废液中不存在盐酸,由于盐酸与碳酸钠反应生成了氯化钠、氯化钙与碳酸钠反应生成了氯化钠,氯化钠显中性和实验中物质不反应,所以一定含有氯化钠。废液中还存在氢氧化钠、碳酸钠、氢氧化钙中的一种或两种;静置,取上层清液于试管中,加入过量氯化钡溶液,有白色沉淀,溶液呈红色,加入过量氯化钡溶液有白色沉淀生成,说明含有碳酸根离子,碳酸钡是白色沉淀,即含有碳酸钠,溶液呈红色说明其中含有氢氧化钠,说明废液中一定存在Na2CO3、NaOH,所以则废液缸中的废液一定含有指示剂、水、碳酸钙、NaCl、Na2CO3、NaOH;在分析化学反应后所得物质的成分时,除了考虑生成物外还需考虑反应物是否有剩余。

【题目】下图为采用“数字化”实验,由传感器采集实验相关信息描绘出曲线,其中物质X表示能与二氧化碳反应的某液体,纵坐标Y表示烧杯中的某个量。下列对物质X与纵坐标Y的分析正确是
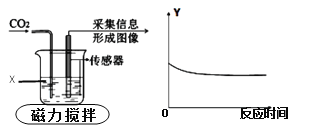
选项 | 物质X | 纵坐标Y |
A | 水 | 溶液的质量 |
B | 水 | 溶液的pH |
C | 氢氧化钠溶液 | 溶质的质量 |
D | 氢氧化钙溶液 | 溶液中钙元素质量 |
A. A B. B C. C D. D