题目内容
【题目】向盛有一定质量稀盐酸的烧杯中逐渐加入石灰石,产生气体质量与石灰石质量的关系如图所示。恰好完全反应后称的烧杯中剩余物质的质量为108.1g,根据关系图分析并计算:
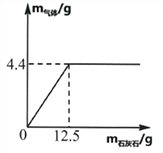
(1)稀盐酸完全反应时,产生CO2气体的物质的量为______________。
(2)该稀盐酸溶质的质量分数为________________。(写出计算过程)。
【答案】 0.1mol 7.3%
【解析】(1)由图可知,生成二氧化碳的质量为4.4g,故二氧化碳的物质的量是4.4g![]() g/mol=0.1 mol;
g/mol=0.1 mol;
(2)设生成4.4g的二氧化碳需要盐酸的质量为x
CaCO3+2HCl == CaCl2+H2O+CO2↑
73 44
x 4.4g
![]() =
=![]() 求得x=7.3g
求得x=7.3g
反应前稀盐酸的质量为108.1g+4.4g-12.5g=100g
稀盐酸中溶质的质量分数为![]() =7.3%。
=7.3%。
答;产生CO2气体的物质的量为0.1 mol; 稀盐酸中溶质的质量分数为7.3%。

 名校课堂系列答案
名校课堂系列答案【题目】溶液在生产、生活中起着十分重要的作用。
(1)可作为溶质的是_______。
A.只有固体 B. 只有液体
C.只有气体 D. 气体、液体、固体都可以
(2)物质加入足量水中,能形成无色透明溶液的是_______。
A.汽油 B. 面粉 C. 纯碱 D. 硫酸铜
(3)物质加入水中形成溶液过程中,温度会升高的是_______。
A.烧碱 B. 氯化钠 D. 氧化钙 D. 碳酸钙
(4)下表是NaCl和KNO3在不同温度时的溶解度,回答问题。
温度/℃ | 10 | 20 | 30 | 40 | 50 | 60 | |
溶解度g/100g水 | NaCl | 35.8 | 36.0 | 36.3 | 36.6 | 37.0 | 37.3 |
KNO3 | 20.9 | 31.6 | 45.8 | 63.9 | 85.5 | 110.0 | |
①两种物质中,溶解度受温度影响变化较大的是__________。
②NaCl和KNO3溶解度相等的温度范围是__________。
③KNO3晶体中含有少量NaCl,提纯KNO3晶体的方法是__________。
④60℃时,按图示操作:
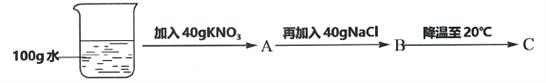
A中溶液是__________(填“饱和”或“不饱和”)溶液,C中溶液的总质量是__________g。
⑤50℃时,将两种物质的饱和溶液各100g,分别加热蒸发10g水后,再恢复到50℃,剩余溶液的质量:NaCl溶液__________(填“大于”“等于”或“小于”)KNO3溶液。