题目内容
【题目】化学兴趣小组要探究放置很久的铝片变质的程度。进行了如下操作,请你参与他们的探究过程(提示:假设样品中的其它成分不与盐酸反应)。
【实验目的】:_____________________________。
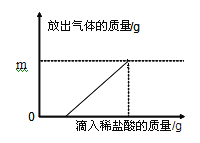
【实验过程】:化学兴趣小组的同学将准确称量的3.6g铝片样品放入80g一定质量分数的稀盐酸中,二者恰好完全反应,最后得到83.3g溶液,反应过程中放出气体的质量与所加稀盐酸质量的关系如如图所示。
【数据处理】:
(1)图中m的值为_____g。
(2)计算铝片中单质铝的质量分数_________
【反思交流】:在金属活动性顺序中,铝的活动性比铁强,但很少见到生活中常用的铝制品生锈,为什么?________________________
【答案】 探究铝片的变质程度… 0.3… 75% 铝是一种比较活泼的金属,常温下很容易跟氧气发生反应,生成一层致密而坚固的氧化铝薄膜,可以阻止内层的铝进一步氧化,对铝制品起到保护作用…
【解析】【实验目的】由题中信息可知,实验目的是探究铝片的变质程度;【数据处理】据质量守恒定律可知反应前后物质的总质量不变,氢气的质量=3.6g+80g-83.3g=0.3g
设生成 0.3 g 氢气需要铝的质量为 x
2Al+6 HCl=2 A1C13+3H2↑
54 6
x 0.3g
54/6=x/0.3g
x=2.7 g
铝片中单质铝的质量分数为:2.7 g/3.6g×100%=75%
【反思交流】铝是一种比较活泼的金属,常温下很容易跟氧气发生反应,生成一层致密而坚固的氧化铝薄膜,可以阻止内层的铝进一步氧化,对铝制品起到保护作用。

练习册系列答案
相关题目