题目内容
【题目】以下是研究实验室制取氧气的装置图,请按要求回答下列问题。
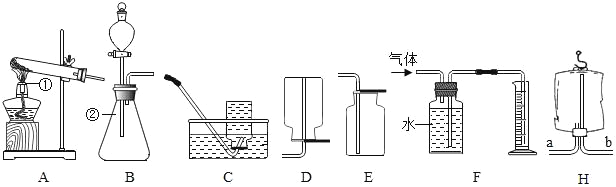
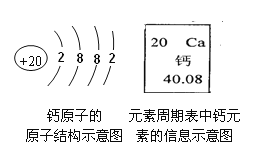
(1)写出图中标号②仪器的名称:______________。
(2)实验室用氯酸钾制取氧气,应选用的发生装置是_____(填字母序号,下同),若要收集一瓶干燥的氧气,应选择的收集装置是______________。
(3)实验室用H2O2溶液和MnO2混合制氧气,该反应的化学方程式为:_________________________________,同学们利用B和F装置,通过排水量来测定生成氧气的体积,反应结束后,发现量筒内收集到的水的体积总是比理论值偏大(水的体积测量准确),其主要原因是:__________________________________________。
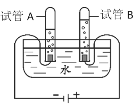
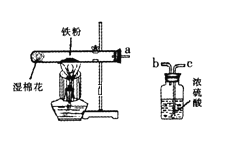
(4)若用图H所示医用塑料袋排空气法收集H2,则H2导入端为_____(填“a”或“b“),理由是_______________________________________________。
【答案】锥形瓶 A E 2H2O2![]() 2H2O+O2↑ 从分液漏斗流入的双氧水占有一定的体积(或反应放热,造成气体膨胀也可 b 氢气的密度比空气的密度小
2H2O+O2↑ 从分液漏斗流入的双氧水占有一定的体积(或反应放热,造成气体膨胀也可 b 氢气的密度比空气的密度小
【解析】
(1)图中标号②仪器的名称锥形瓶,故填锥形瓶。
(2)用氯酸钾制取氧气是加热固体生成气体,应选择固体受热发生装置,故填A;
收集干燥的气体,应选择排空气法,收集干燥的氧气,选择向上排空气法,故填E。
(3)过氧化氢在二氧化锰作催化剂的条件下反应生成水和氧气,故反应的化学方程式写为:. 2H2O2![]() 2H2O+O2↑;
2H2O+O2↑;
原因是从分液漏斗流入的双氧水占有一定的体积,或反应放热,造成气体膨胀,故填从分液漏斗流入的双氧水占有一定的体积(或反应放热,造成气体膨胀)。
(4)用图H所示医用塑料袋排空气法收集H2,则H2导入端为长管,故填b;
由于氢气的密度小于空气的密度,所以氢气应从长管进入,故填氢气的密度比空气的密度小。

 宝贝计划期末冲刺夺100分系列答案
宝贝计划期末冲刺夺100分系列答案 能考试全能100分系列答案
能考试全能100分系列答案【题目】如图是木炭还原氧化铜的探究实验装置:
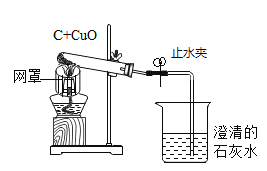
(提出问题)木炭还原氧化铜产生什么气体?
(提出猜想)产生的气体有三种情况:①CO;②CO2;③________。
(设计方案)实验前后分别对试管和烧杯里的物质进行称量,数据设计如下
称量对象 | 反应前质量 | 反应后质量 | 质量差 |
试管+固体混合物 | M1 | M2 | △m1即(M1﹣M2) |
烧杯+澄清石灰水 | M3 | M4 | △m2即(M4﹣M3) |
(1)若△m2=0,说明反应产生的气体不能被澄清石灰水吸收,则猜想_____(填“①”、“②”或“③”)成立。
(2)若猜想②正确,理论上△m1与△m2的关系是:△m1_____△m2(填“>”、“<”或“=”)。
(实验并记录)实验得到的数据如下表:
称量对象 | 反应前质量 | 反应后质量 | 质量差 |
试管+固体混合物 | 69.89g | 65.49g | △m1 |
烧杯+澄清石灰水 | 118.9g | 122.6g | △m2 |
用以上实验数据分析,结果应该是猜想_______(填“①”、“②”或“③”)成立。
同学们对CO产生的原因进行了
原因一:木炭和氧化铜在高温条件下直接发生反应产生CO,反应方程式为:_________。
原因二:木炭和氧化铜在高温条件下反应中的一种产物和反应物木炭又发生了化学反应,产生了CO,反应方程式为:________。
(反思与评价)经查阅资料知道:木炭还原氧化铜产生CO2气体,反应化学方程式为:__________。
本次实验结果与资料显示不一致对其可能原因有同学提出下列分析,其中合理的是_______(填字母)。
A.装置漏气 B.生成的CO2部分与过量的C反应生成了CO
C.澄清石灰水吸收CO2效果不好 D.装置内还有CO2气体未被吸收
按本装置进行实验,待反应结束,先将导气管从石灰水中取出,然后关闭止水夹,让产物自然冷却。若不关闭止水夹,可能出现的问题是________。
(定量分析)6克碳与一定质量的氧化铜恰好完全反应,生成的气体完全被足量的石灰水吸收,可得到沉淀________克。(要求:写出计算过程)