题目内容
【题目】小雪同学想测定某CuAg合金中两种金属的质量比。称取这种合金9.6 g,加入足量AgNO3溶液充分反应后过滤,将所得固体洗涤、干燥后称量,质量为24.8 g。
(1)发生反应的化学方程式为_________。
(2)试计算该合金中铜与银的质量比(请写出计算过程) _________。
【答案】Cu+2AgNO3===Cu(NO3)2+2Ag 2∶1。
【解析】
(1)根据铜和硝酸银反应生成硫酸铜和银进行分析;
(2)根据反应前后质量的差值求出铜的质量,进而求出银的质量进行解答。
(1)铜和硝酸银反应生成硫酸铜和银,化学方程式为:Cu+2AgNO3=Cu(NO3)2+2Ag;
(2)设9.6gCu-Ag合金中Cu的质量为x,
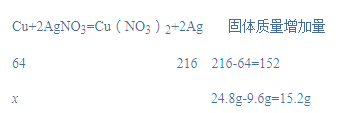
![]()
x=6.4g,
m(Ag)=9.6g-6.4g=3.2g,m(Cu):m(Ag)=6.4g:3.2g=2:1;
答:该合金中铜与银的质量比为 2:1。

练习册系列答案
 名师指导期末冲刺卷系列答案
名师指导期末冲刺卷系列答案
相关题目
【题目】利用图所示装置(气密性良好)分别进行以下实验,最终U型管中两侧液面的相对高度不正确的是(加入试管中的试剂X所占体积忽略不计)
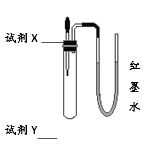
试剂X | 试剂Y | 相对高度 | |
A | 水 | 氧化钙(少量) | 左低右高 |
B | 过氧化氢溶液 | 二氧化锰(少量) | 左低右高 |
C | 稀盐酸 | 石灰石(少量) | 左低右高 |
D | 澄清石灰水 | 二氧化碳 | 左高右低 |
A. A B. B C. C D. D