题目内容
【题目】尿素是一种重要的氮肥,其化学式为CO(NH2)2,尿素中含有________种元素,所含氮元素与氧元素的原子个数比为___________,尿素的摩尔质量是______________,尿素中含氮元素的质量分数为___________,0.5mol尿素中约含氢原子_________个。
【答案】 4 2:1 60g/mol 7/15(或0.47) 1.204×1024
【解析】根据化学式为CO(NH2)2,可知其尿素由4种元素组成;一个尿素分子由1个C原子、1个O原子、2个N原子和4个H原子所构成,因此尿素分子中N、O的原子个数比=2:1;尿素的相对分子质量为60,则尿素的摩尔质量为60g/mol;尿素CO(NH2)2中氮元素的质量分数=![]() ×100%=47%;0.5mol尿素中含有0.5×4×6.02×1023=1.204×1024个氢原子。
×100%=47%;0.5mol尿素中含有0.5×4×6.02×1023=1.204×1024个氢原子。

练习册系列答案
相关题目
【题目】请从33-A或33-B两题中任选一个作答,若两题均作答,按33-A计分。
33-A | 33-B |
|
|
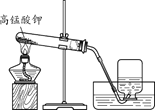
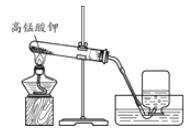
(1)实验室用高锰酸钾制取氧气的化学方程式为_____。 (2)证明收集到的气体为氧气的方法是_____。 | (1)用大理石和稀盐酸制取二氧化碳的化学方程式为_____。 (2)检验二氧化碳已经收集满的方法 是_____。 |