题目内容
【题目】工业上制取硝酸铵(NH4NO3)的流程图如下,请回答下列问题。
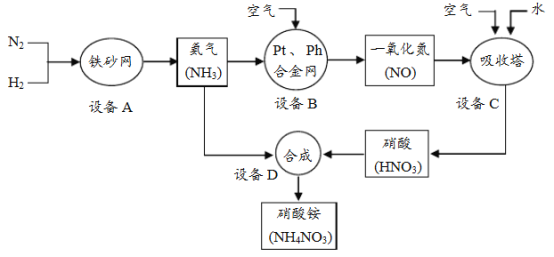
(1)设备A中,发生的反应属于基本反应类型中的________。
(2)设备B、C中,空气中的______一定参加了反应。
(3)设备C中,生产硝酸过程排出的废气中会含有一些氮的氧化物,可用如下两种
方法处理:
方法一、NaOH溶液吸收法:NO + NO2 + 2NaOH = 2NaNO2 + H2O
方法二、NH3还原法:8NH3 + 6NO2![]() 7N2 + 12H2O(NO也有类似的反应)
7N2 + 12H2O(NO也有类似的反应)
以上两种方法中,你认为哪种方法好并说明理由________。
(4)设备D中,用NH3和HNO3制备NH4NO3。NH4NO3中氮元素质量分数的计算式为________。
【答案】 化合反应 氧气 方法一,简单易行,方法二,环保 ![]()
【解析】本题用工业上制取硝酸铵(NH4NO3)的流程图考查了阅读获得信息的能力,在(2)题中根据质量守恒进行分析。
(1)设备A中,发生了N2和H2生成了NH3的反应,属于基本反应类型中的化合反应;
(2)设备B中 NH3→NO、设备C中NO→HNO3,根据质量守恒定律,在设备B、C中,空气中的氧气一定参加了反应;
(3)方法一在常温就能发生化学反应,方法一,简单易行,方法二中NH3 和 NO反应生了氮气和水,无污染,方法二,环保;
(4)NH4NO3中氮元素质量分数=![]()
点睛:在流程题中关注“箭头”及方框内的信息:箭头进入的是投料(即反应物),出去的是生成物(包括主产物和副产物)。
【题型】流程题
【结束】
22
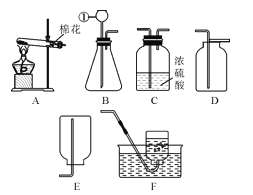
【题目】下图为实验室用高锰酸钾制取氧气的装置。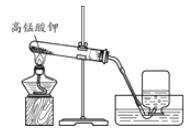
(1)实验中反应的化学方程式为________。
(2)氧气可用排水法收集的原因是________。
【答案】 2KMnO4 ![]() K2MnO4 + MnO2 + O2↑ 氧气不易溶于水
K2MnO4 + MnO2 + O2↑ 氧气不易溶于水
【解析】本题考查实验用高锰酸钾制氧气。
(1)图1为实验室用高锰酸钾制取氧气反应生成锰酸钾、二氧化锰和氧气,化学方程式为:2KMnO4 ![]() K2MnO4 + MnO2 + O2↑
K2MnO4 + MnO2 + O2↑
(2)氧气可用排水法收集的原因是:氧气不易溶于水。

【题目】某研究小组用下图所示装置,探究能否用镁条代替红磷测定空气中氧气含量。
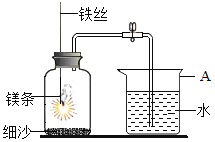
实验前,小组成员提出了不同的猜想。
【猜想与假设】
猜想1:可以代替,因为镁条与氧气反应后不会产生气体
猜想2:不能代替,查阅资料知金属镁很活泼,可能会与空气中的氮气反应
【进行实验】
步骤 | 实验操作 | 实验现象 |
Ⅰ | 组装好装置后,打开止水夹,手捂集气瓶,一段时间后,松开手 | 烧杯中导管口有气泡冒出,松手后,烧杯中导管末端有一段液柱 |
Ⅱ | 关闭止水夹,点燃镁条,迅速伸入集气瓶中,塞好塞子 | 镁条燃烧,放出大量热,发出耀眼白光,生成大量白烟,剩余固体为白色带状物 |
Ⅲ | 冷却至室温,打开止水夹 | 烧杯中水从导管进入集气瓶中,体积约为集气瓶体积的2/5 |
【解释与结论】
(1)Mg与氧气反应的化学方程式为_________。
(2)步骤Ⅰ说明装置的气密性_________。
(3)步骤Ⅱ中,关闭止水夹的目的是_________。
(4)推测猜想2成立的现象证据是_________。
【反思与评价】
(5)该小组认为,即使步骤Ⅲ中水的体积恰好占集气瓶体积的1/5,也不能说明猜想1成立,理由是_________。
(6)小组中同学对镁条与瓶中气体的反应提出了进一步的猜想:甲同学认为镁条先与O2反应,乙同学认为镁条先与N2反应。为进一步检验他们的猜想,可以进行的实验操作是:取少量镁条,点燃后迅速放入盛有空气的集气瓶中,待镁条熄灭后,________。
【题目】某研究小组用下图所示装置,探究能否用镁条代替红磷测定空气中氧气含量。

实验前,小组成员提出了不同的猜想。
【猜想与假设】
猜想1:可以代替,因为镁条与氧气反应后不会产生气体
猜想2:不能代替,查阅资料知金属镁很活泼,可能会与空气中的氮气反应
【进行实验】
步骤 | 实验操作 | 实验现象 |
Ⅰ | 组装好装置后,打开止水夹,手捂集气瓶,一段时间后,松开手 | 烧杯中导管口有气泡冒出,松手后,烧杯中导管末端有一段液柱 |
Ⅱ | 关闭止水夹,点燃镁条,迅速伸入集气瓶中,塞好塞子 | 镁条燃烧,放出大量热,发出耀眼白光,生成大量白烟,剩余固体为白色带状物 |
Ⅲ | 冷却至室温,打开止水夹 | 烧杯中水从导管进入集气瓶中,体积约为集气瓶体积的2/5 |
【解释与结论】
(1)Mg与氧气反应的化学方程式为_________。
(2)步骤Ⅰ说明装置的气密性_________。
(3)步骤Ⅱ中,关闭止水夹的目的是_________。
(4)推测猜想2成立的现象证据是_________。
【反思与评价】
(5)该小组认为,即使步骤Ⅲ中水的体积恰好占集气瓶体积的1/5,也不能说明猜想1成立,理由是_________。
(6)小组中同学对镁条与瓶中气体的反应提出了进一步的猜想:甲同学认为镁条先与O2反应,乙同学认为镁条先与N2反应。为进一步检验他们的猜想,可以进行的实验操作是:取少量镁条,点燃后迅速放入盛有空气的集气瓶中,待镁条熄灭后,________。
【题目】如图,硒被誉为“抗癌大王”.根据提供的硒的有关信息,下列说法中,正确的是( )
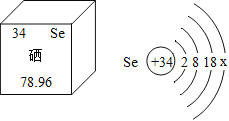
A. 硒属于金属元素
B. 硒的原子序数是34
C. 硒的原子结构示意图中x=4
D. 硒的相对原子质量是78.96 g
【题目】课外实验:“叶脉书签”(如图)的制作过程是将洗干净的树叶放在一定浓度的氢氧化钠溶液中煮沸,再加以处理,除去表皮和叶肉,只余清晰的叶脉,就能得到“叶脉书签”。实验小组同学对该制作过程及氢氧化钠的性质进行了研究。

I.探究制作“叶脉书签”的最佳条件
【查阅资料】
氢氧化钠溶液有腐蚀性。
【进行实验】
实验1:相同煮沸时间内,将洗干净的树叶放在不同浓度的氢氧化钠溶液里,处理后叶片变化如下表。
NaOH溶液浓度 | 1% | 5% | 10% |
叶片变化 | 留有很多叶肉 | 留有较多叶肉 | 残留很少叶肉 |
实验2:在10%的氢氧化钠溶液里,将洗干净的树叶进行不同时间的煮沸,处理后叶片变化如下表。
煮沸时间 | 5min | 15min | 20min |
叶片变化 | 留有较多叶肉 | 残留很少叶肉 | 叶片卷起来,叶肉与叶脉不易分离 |
【解释与结论】
(1)实验1的实验目的是_______________。
(2)实验小组同学选择了10%的氢氧化钠溶液制作“叶脉书签”,原因是___________。
(3)通过实验2可知,制作“叶脉书签”的最佳煮沸时间是__________(填字母序号)。
A.5min B.15min C.20min
II.探究氢氧化钠的性质
【查阅资料】
a.氢氧化钠与氢氧化钙化学性质相似
b.稀盐酸与碳酸钠(Na2CO3)反应的化学方程式为:2HCl + Na2CO3==2NaCl + H2O +CO2↑
c.通常状况下,1体积的水约能溶解1体积二氧化碳
【猜想与假设】
(4)氢氧化钠能与二氧化碳发生反应,其化学方程式为:2NaOH +CO2==Na2CO3 +_________
【进行实验】
实验步骤 | 实验现象 |
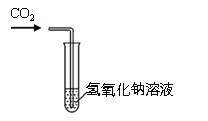
| 无明显变化 |
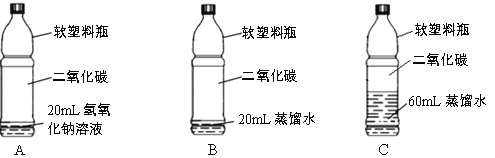
甲同学发现实验步骤①中无明显变化,产生疑问:两种物质是否发生了化学反应?在老师的帮助下,通过对比实验步骤②③证明NaOH与二氧化碳发生了反应。
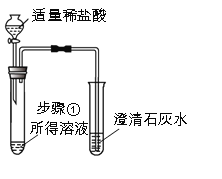
实验步骤 | 实验现象 |
| A中有大量气泡产生, B中____________。 |
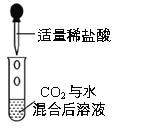
| 无明显变化 |
【解释与结论】
(5)步骤②中通过B中实验现象,可知稀盐酸加入到步骤①所得溶液中有二氧化碳产生。
(6)实验③的目的是排除________________的干扰。
(7)乙同学认为用软塑料瓶也可以验证氢氧化钠与二氧化碳的反应,需要对比的实验装置有__________(填字母序号)。