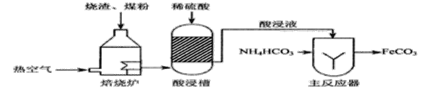
��Ŀ����
����Ŀ������ͭ���Ʊ�![]() ϵ��������Ҫԭ�ϣ�ij��ȤС�������չ�������о���
ϵ��������Ҫԭ�ϣ�ij��ȤС�������չ�������о���
![]() ����ͭ���Ʊ��о�
����ͭ���Ʊ��о�
��С��ͬѧ�������Ϸ�����������Ʒ����ɹ�ѡ�ã�
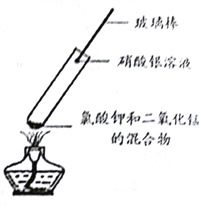
![]() ��ϡ���ᷴӦ��ȡ��
��ϡ���ᷴӦ��ȡ��![]()
![]() ��Ũ���ᷴӦ��ȡ��
��Ũ���ᷴӦ��ȡ��![]()
![]() ͨ������ͭм��ϡ�������ϵ����ȡ��
ͨ������ͭм��ϡ�������ϵ����ȡ��![]()
��ͬѧ��Ϊ���ַ����ķ�Ӧ�����������������н��У���ͬѧ��Ϊ______![]() ��������������������
��������������������![]() ��������
��������![]() ��һ����ѧ����ʽ��ʾ
��һ����ѧ����ʽ��ʾ![]() ______
______![]() �ӻ��������;���Ч��Ƕȿ��ǣ���ȡ����������ͭ���˲������Ϸ���______��������_________��
�ӻ��������;���Ч��Ƕȿ��ǣ���ȡ����������ͭ���˲������Ϸ���______��������_________��
![]() ����ͭ�������о�
����ͭ�������о�
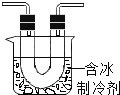
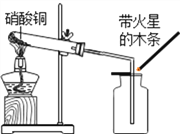
����ͭΪ��ɫ���壬����ˮ�ɵ���ɫ��Һ![]() ��С��ͬѧ����ͼװ�ü�������ͭ�����ֹ�������ɫ��ڣ�ͬʱ��������ɫ�д̼�����ζ�����壬�����ǵ�ľ����ȼ��
��С��ͬѧ����ͼװ�ü�������ͭ�����ֹ�������ɫ��ڣ�ͬʱ��������ɫ�д̼�����ζ�����壬�����ǵ�ľ����ȼ��
��������⡿����ͭ�ڼ��������µ������������ķ�Ӧ��
���������ϡ�
![]() ����ͭ��ϡ���ᷴӦ�Ļ�ѧ����ʽ��
����ͭ��ϡ���ᷴӦ�Ļ�ѧ����ʽ��![]()
![]() �����������У�ֻ��
�����������У�ֻ��![]() �Ǻ���ɫ���д̼�����ζ�����壮
�Ǻ���ɫ���д̼�����ζ�����壮
![]() ����ȼ�ԣ���ʹ�����ǵ�ľ����ȼ
����ȼ�ԣ���ʹ�����ǵ�ľ����ȼ
��������衿
![]() ���ȷֽ��������______��������������CuO��
���ȷֽ��������______��������������CuO��![]() ��
��
������ʵ�顿
ʵ����� | ʵ������ | ʵ����� |
����I������Ӧ���Թ��еĹ����ˮ����ܽ⣬���ˣ� ______ ������ | ����ȫ���ܽ⣬�õ���ɫ��Һ | ����ͭ�ֽ�����������ͭ�� |
����II������ͼ���Թܺͼ���ƿ֮�����ϴ�ͼ��ʾ��װ�ã����½��м�������ͭ��ʵ�� | ����ƿ������Ϊ��ɫ��______ | ����ͭ�ֽ����������� |
����II��ͬѧ�Dz������µ����Ϻ������ɵ�![]() �������ǹ���
�������ǹ���![]() ______�����������Ϣ��
______�����������Ϣ��
����ý��ۡ�����ʵ������![]() ���ȷֽ�Ļ�ѧ����ʽΪ______��
���ȷֽ�Ļ�ѧ����ʽΪ______��
��С��ͬѧȡ10g������ͭ����һ��ʱ����ʣ����������Ϊ![]() ��������ͭ�ķֽ���Ϊ______��
��������ͭ�ķֽ���Ϊ______��![]() �ֽ���Ϊ�ѷֽ������ͭռԭ����ͭ������������д���������
�ֽ���Ϊ�ѷֽ������ͭռԭ����ͭ������������д���������![]()
����˼�����ۡ�
��֪��ͬ״���£����������ȵ�������Ӹ�����![]() �ݴˣ�ͬѧ����Ϊ����ʹû������
�ݴˣ�ͬѧ����Ϊ����ʹû������![]() ������ʵ����ۺ�����������ͭ������������ʹ�����ǵ�ľ����ȼ����ʵ������Ҳ���Ƴ�
������ʵ����ۺ�����������ͭ������������ʹ�����ǵ�ľ����ȼ����ʵ������Ҳ���Ƴ�![]() ���ܾ�����ȼ��
���ܾ�����ȼ��![]() ������______��
������______��
���𰸡� ������ ![]() ��
�� ![]() ��
��![]() �з�Ӧ����û���ж��������ɣ�����Ⱦ���������������ʸ�
�з�Ӧ����û���ж��������ɣ�����Ⱦ���������������ʸ� ![]() �������м�������ϡ���� �����ǵ�ľ����ȼ �е�
�������м�������ϡ���� �����ǵ�ľ����ȼ �е� ![]()
![]() ����ͭ�ֽ����ɵ�������
����ͭ�ֽ����ɵ�������![]() ��
��![]() �������Ϊ4��
�������Ϊ4��![]() ��ռ����������������
��ռ����������������![]() �����������ͬ���ֽ�����������ʹ������ľ����ȼ���������ܣ�˵��
�����������ͬ���ֽ�����������ʹ������ľ����ȼ���������ܣ�˵��![]() ����ȼ��
����ȼ��
��������![]() ���ַ����ķ�Ӧ�������������������н��У����������Ļ�Ա�ͭǿ����
���ַ����ķ�Ӧ�������������������н��У����������Ļ�Ա�ͭǿ����![]() ���ӻ��������;���Ч��Ƕȿ��ǣ���ȡ����������ͭ���˲��õķ���
���ӻ��������;���Ч��Ƕȿ��ǣ���ȡ����������ͭ���˲��õķ���![]() �����������٢ڲ�����Ⱦ�������к����壻�۷�Ӧ���������ж��������ɣ�����Ⱦ���������������ʸ�����������衿��������ͭ�����ֹ�������ɫ��ڣ�ͬʱ��������ɫ���д̼�����ζ�����壬�����ǵ�ľ����ȼ��˵������������ͭ����ɫ���壩����������ȼ�����壬ʹ�����ǵ�ľ����ȼ��������
�����������٢ڲ�����Ⱦ�������к����壻�۷�Ӧ���������ж��������ɣ�����Ⱦ���������������ʸ�����������衿��������ͭ�����ֹ�������ɫ��ڣ�ͬʱ��������ɫ���д̼�����ζ�����壬�����ǵ�ľ����ȼ��˵������������ͭ����ɫ���壩����������ȼ�����壬ʹ�����ǵ�ľ����ȼ��������![]() ������ɫ���壩��������ʵ�顿��Ϊ����ͭ������ˮ������ͨ���ܽ⣬���ˣ�ϴ�ӵķ�ʽ����������ʽ��з��롣�������ϡ���ᣬϡ����������ͭ��Ӧ��������ͭ���õ���ɫ��Һ��NO2������Һ����ͨ������������ܽ���Һ�����Ӷ�������������룬ʣ��������Կ���ʹ������ľ����ȼ��˵��Cu��NO3��2���ȷֽ����������������ý��ۡ�����ʵ������
������ɫ���壩��������ʵ�顿��Ϊ����ͭ������ˮ������ͨ���ܽ⣬���ˣ�ϴ�ӵķ�ʽ����������ʽ��з��롣�������ϡ���ᣬϡ����������ͭ��Ӧ��������ͭ���õ���ɫ��Һ��NO2������Һ����ͨ������������ܽ���Һ�����Ӷ�������������룬ʣ��������Կ���ʹ������ľ����ȼ��˵��Cu��NO3��2���ȷֽ����������������ý��ۡ�����ʵ������![]() ���ȷֽ�Ļ�ѧ����ʽΪ
���ȷֽ�Ļ�ѧ����ʽΪ![]() ���跴Ӧ������ͭ������Ϊx
���跴Ӧ������ͭ������Ϊx
2Cu��NO3��2 ![]() 2CuO + 4NO2��+O2�����������
2CuO + 4NO2��+O2�����������
376������������ 160�������������� ��216
X���������������������������� 10g��4.6g
376/x=216/��10g��4.6g��![]()
X=9.2g��������
������ͭ�ķֽ���Ϊ��9.2g��10g��100%=92%
����˼�����ۡ�ͨ����ѧ��Ӧ������ͭ�ֽ����ɵ�������NO2��O2�������Ϊ4��1��O2��ռ����������������O2�����������ͬ���ֽ�����������ʹ������ľ����ȼ���������ܣ�˵��NO2����ȼ�ԡ�

 ��ѧ����ϵ�д�
��ѧ����ϵ�д� �ο�������ϵ�д�
�ο�������ϵ�д�����Ŀ��ij��ѧ��ȤС����̽������Ļ�ѧ���ʣ���������ʵ�飺
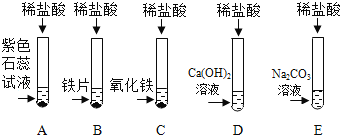
(1)�Թ�A�е�������________����Ӧ���Թ�B��һ���е���������______(д���ӷ���)��
(2)�Թ�C�з�Ӧ�Ļ�ѧ����ʽΪ___________��
(3)ʵ�������С��ͬѧ��D��E��֧�Թ��еķ�Һͬʱ����һ���ྻ���ձ��У��۲쵽�������ݲ��������а�ɫ�������ɡ�ͬѧ�ǽ��ձ��ڵ����ʽ��й��ˣ���������Һ�����ʳɷֽ���̽����
��������롿
��ͬѧ���룺NaCl�� ��ͬѧ���룺NaCl��CaCl2����ͬѧ���룺NaCl��CaCl2��HCl��
��ͬѧ�IJ��룺NaCl��Na2CO3��
���������ϡ�NaCl��CaCl2��Һ��������
���������ۡ���ͬѧ��Ϊ��ͬѧ�IJ���һ������ȷ��������____________��
�����ʵ�顿�ҡ�����λͬѧ�ֱ��������ʵ����֤�Լ��IJ��룺
ʵ�鷽�� | ʵ�鲽�� | ʵ������ | ʵ����� |
�� | ȡ������Һ���Թ��У������еμ���ɫ��̪��Һ | ���������� | ������ȷ |
�� | ȡ������Һ���Թ��У������еμ�ϡ���� | ______ | ������ȷ |
����˼���ۡ�ʵ�������ͬѧ��Ϊ_____(����������������)ͬѧ��ʵ����۴���ԭ����_____________��