题目内容
【题目】工业上用硫铁矿“烧渣”(主要成分是Fe3O4、 Fe2O3)、煤粉作原料制备FeCO3的主要流程如下:
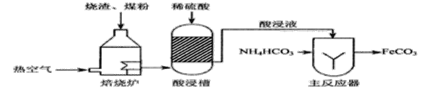
(1)焙烧所得的非气态物用稀硫酸“酸浸”时,会产生少量可燃性气体,生成该气体的化学方程式为_________________。
(2)主反应器中,溶液温度控制在35℃以下的主要原因是__________。
(3)医疗上用碳酸亚铁(FeCO3)给病人食用,可用于防治_____________。
【答案】 Fe + H2SO4 === FeSO4 + H2↑ 碳酸氢铵受热易分解 缺铁性贫血
【解析】(1) 焙烧所得的非气态物可能有生成的铁,所以用稀硫酸“酸浸”时,会产生少量可燃性气体氢气,所以生成该气体的化学方程式为Fe+H2SO4=FeSO4+H2↑;(2) 主反应器中,由于碳酸氢铵受热易分解,所以溶液温度控制在35℃以下;(3)医疗上将酸亚铁(FeCO3)与砂糖混合给病人食用,用于防治贫血。

 阅读快车系列答案
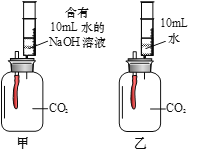
阅读快车系列答案【题目】某小组同学为探究氢氧化钠的性质进行了如下实验。
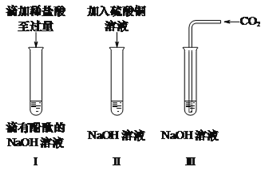
① 试管Ⅰ中观察到的现象是_____,发生反应的化学方程式是______。
② 试管Ⅱ中反应后的上层清液为蓝色,则其中的溶质是______。
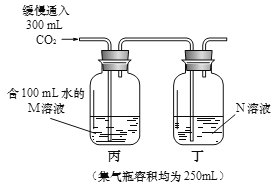
③ 试管Ⅲ中没有明显现象,为证明氢氧化钠能与二氧化碳发生反应,该小组设计了如下两个实验(通常状况下1体积水中溶解1体积二氧化碳;集气瓶容积均为250mL;装置气密性良好)。
实验目的:证明氢氧化钠能和二氧化碳反应 | |
方案一 | 方案二 |
|
|
方案一:分别将液体全部注入集气瓶中充分反应后,观察到______,证明氢氧化钠和二氧化碳发生了反应。
方案二:M溶液的溶质是______,N溶液的溶质是______,判断氢氧化钠与二氧化碳发生反应的依据是______,为确保实验目的的达成,该方案中还应注意的问题是______。
【题目】硝酸铜是制备![]() 系催化剂的重要原料,某兴趣小组对它开展了以下研究.
系催化剂的重要原料,某兴趣小组对它开展了以下研究.
![]() 硝酸铜的制备研究
硝酸铜的制备研究
该小组同学查阅资料发现有三种设计方案可供选用:
![]() 与稀硝酸反应制取:
与稀硝酸反应制取:![]()
![]() 与浓硝酸反应制取:
与浓硝酸反应制取:![]()
![]() 通氧气于铜屑与稀硝酸的体系中制取:
通氧气于铜屑与稀硝酸的体系中制取:![]()
甲同学认为三种方案的反应都可以在铁制容器中进行,乙同学认为______![]() 填“可行”“不可行”
填“可行”“不可行”![]() ,理由是
,理由是![]() 用一个化学方程式表示
用一个化学方程式表示![]() ______
______![]() 从环境保护和经济效益角度考虑,制取大量的硝酸铜最宜采用以上方法______,理由是_________.
从环境保护和经济效益角度考虑,制取大量的硝酸铜最宜采用以上方法______,理由是_________.
![]() 硝酸铜的性质研究
硝酸铜的性质研究
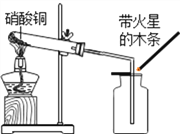
硝酸铜为蓝色固体,溶于水可得蓝色溶液![]() 该小组同学用如图装置加热硝酸铜,发现固体由蓝色逐渐变黑,同时产生红棕色有刺激性气味的气体,带火星的木条复燃.
该小组同学用如图装置加热硝酸铜,发现固体由蓝色逐渐变黑,同时产生红棕色有刺激性气味的气体,带火星的木条复燃.
【提出问题】硝酸铜在加热条件下到底发生了怎样的反应?
【查阅资料】
![]() 氧化铜和稀硫酸反应的化学方程式:
氧化铜和稀硫酸反应的化学方程式:![]()
![]() 含氮化合物中,只有
含氮化合物中,只有![]() 是红棕色、有刺激性气味的气体.
是红棕色、有刺激性气味的气体.
![]() 有助燃性,能使带火星的木条复燃
有助燃性,能使带火星的木条复燃
【猜想假设】
![]() 受热分解除了生成______,还可能生成了CuO和
受热分解除了生成______,还可能生成了CuO和![]() .
.
【进行实验】
实验操作 | 实验现象 | 实验结论 |
步骤I:将反应后试管中的固体加水充分溶解,过滤, ______ ,加热 | 固体全部溶解,得到蓝色溶液 | 硝酸铜分解生成了氧化铜. |
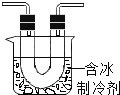
步骤II:在如图的试管和集气瓶之间连上此图所示的装置,重新进行加热硝酸铜的实验 | 集气瓶中气体为无色,______ | 硝酸铜分解生成了氧气 |
步骤II是同学们查阅了新的资料后设计完成的![]() 该资料是关于
该资料是关于![]() ______方面的性质信息.
______方面的性质信息.
【获得结论】根据实验结果,![]() 受热分解的化学方程式为______.
受热分解的化学方程式为______.
该小组同学取10g的硝酸铜加热一段时间后,测得剩余固体的质量为![]() ,则硝酸铜的分解率为______?
,则硝酸铜的分解率为______?![]() 分解率为已分解的硝酸铜占原硝酸铜的质量分数,写出计算过程
分解率为已分解的硝酸铜占原硝酸铜的质量分数,写出计算过程![]()
【反思与评价】
已知相同状况下,气体的体积比等于其分子个数比![]() 据此,同学们认为,即使没有资料
据此,同学们认为,即使没有资料![]() ,依据实验结论和“加热硝酸铜产生的气体能使带火星的木条复燃”的实验现象,也能推出
,依据实验结论和“加热硝酸铜产生的气体能使带火星的木条复燃”的实验现象,也能推出![]() 可能具有助燃性
可能具有助燃性![]() 理由是______.
理由是______.
【题目】除去下列各组物质中的少量杂质,所用方法不正确的是:
选项 | 物质 | 杂质 | 除去杂质的方法 |
A | NaCl | Na2CO3 | 加入足量的稀盐酸不再有气体产生,蒸发 |
B | N2 | O2 | 通过红热的铜丝 |
C | KNO3溶液 | Ba(NO3)2 | 滴加适量K2SO4溶液、过滤 |
D | Ca(OH)2 | CaCO3 | 滴入足量稀盐酸至不再产生气体 |
A. A B. B C. C D. D