题目内容
【题目】加热氯酸钾(化学式为KClO3)和催化剂二氧化锰的混合物可制备氧气,同时生成氯化钾,该反应的化学方程式为________,但实验中发现有刺激性气味的气体产生。
【提出问题】刺激性气味的气体是什么呢?
【猜想假设】猜想一:臭氧(化学式为O3) 猜想二:HCl 猜想三:Cl2
同学们认为不需实验验证就可以判断猜想________是错误的,理由为________。
【查阅资料】
(1)C12+H20===HC10+HCl, AgNO3 +HCl===AgCl↓ + HNO3。
(2)臭氧在MnO2存在的情况下极易分解成氧气。
(3)氯气可使湿润的淀粉碘化钾试纸变蓝。
【实验探究】
查阅资料后大家认为猜想一是错误的,理由为________。
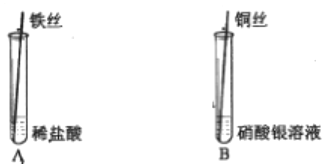
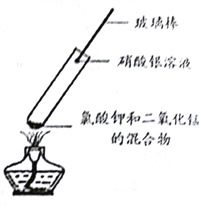
他们进一步又做了如下实验:取氯酸钾和二氧化锰的混合物放人试管中加热,将蘸有硝酸银溶液的玻璃棒伸入试管口(如右图),看到的现象是________,再将湿润的淀粉碘化钾试纸悬于试管口,试纸变________色,最终证明猜想三正确。
【反思拓展】
(1)欲证明二氧化锰是氯酸钾分解的催化剂,需证明二氧化锰的________在反应前后不变。
(2)自来水厂常用氯气来杀菌消毒,氯气和水反应后会产生H+、Clˉ和ClOˉ,而野外常用漂白粉[主要成分化学式为Ca(ClO)2]。你认为在水中起杀菌消毒作用的离子是________。
【答案】 2KClO3![]() 2KCl+3O2↑ 二 反应物中不含氢元素或不遵循质量守恒定律 臭氧在MnO2存在情况下极易分解成氧气 溶液出现白色浑浊 蓝 质量和化学性质 ClO-
2KCl+3O2↑ 二 反应物中不含氢元素或不遵循质量守恒定律 臭氧在MnO2存在情况下极易分解成氧气 溶液出现白色浑浊 蓝 质量和化学性质 ClO-
【解析】本题考查了质量守恒定律,氯离子的检验,催化剂,获得信息,利用信息的能力。
加热氯酸钾(化学式为KClO3)和催化剂二氧化锰的混合物可制备氧气,同时生成氯化钾,该反应的化学方程式为2KClO3![]() 2KCl+3O2↑;
2KCl+3O2↑;
猜想假设:同学们认为不需实验验证就可以判断猜想二是错误的,理由为反应物中不含氢元素或不遵循质量守恒定律;
实验探究:臭氧在MnO2存在的情况下极易分解成氧气,所以反应过程中不可能臭氧生成,猜想一错误;氯气和水反应后会产生盐酸和次氯酸,硝酸银与盐酸反应生成物氯化银沉淀和氯化钠,将蘸有硝酸银溶液的玻璃棒伸入试管口(如右图),看到的现象是溶液出现白色浑浊;若猜想三正确,刺激性气味的气体是氯气,氯气可使湿润的淀粉碘化钾试纸变蓝。将湿润的淀粉碘化钾试纸悬于试管口,试纸变蓝色。
反思拓展:(1) 催化剂能改变化学反应的速率,而本身的质量和化学性质不变。欲证明二氧化锰是氯酸钾分解的催化剂,需证明二氧化锰的质量和化学性质在反应前后不变;
(2)氯气和水反应后会产生H+、Clˉ和ClOˉ,漂白粉[主要成分化学式为Ca(ClO)2]在水中能电离出ClO-。在水中起杀菌消毒作用的离子是ClO-。

 A加金题 系列答案
A加金题 系列答案 全优测试卷系列答案
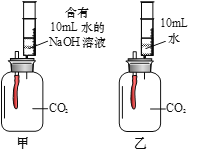
全优测试卷系列答案【题目】某小组同学为探究氢氧化钠的性质进行了如下实验。
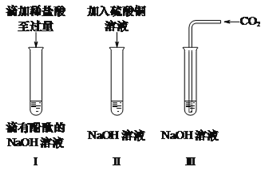
① 试管Ⅰ中观察到的现象是_____,发生反应的化学方程式是______。
② 试管Ⅱ中反应后的上层清液为蓝色,则其中的溶质是______。
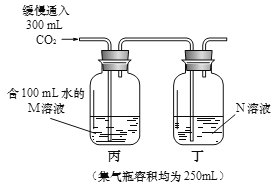
③ 试管Ⅲ中没有明显现象,为证明氢氧化钠能与二氧化碳发生反应,该小组设计了如下两个实验(通常状况下1体积水中溶解1体积二氧化碳;集气瓶容积均为250mL;装置气密性良好)。
实验目的:证明氢氧化钠能和二氧化碳反应 | |
方案一 | 方案二 |
|
|
方案一:分别将液体全部注入集气瓶中充分反应后,观察到______,证明氢氧化钠和二氧化碳发生了反应。
方案二:M溶液的溶质是______,N溶液的溶质是______,判断氢氧化钠与二氧化碳发生反应的依据是______,为确保实验目的的达成,该方案中还应注意的问题是______。
【题目】硝酸铜是制备![]() 系催化剂的重要原料,某兴趣小组对它开展了以下研究.
系催化剂的重要原料,某兴趣小组对它开展了以下研究.
![]() 硝酸铜的制备研究
硝酸铜的制备研究
该小组同学查阅资料发现有三种设计方案可供选用:
![]() 与稀硝酸反应制取:
与稀硝酸反应制取:![]()
![]() 与浓硝酸反应制取:
与浓硝酸反应制取:![]()
![]() 通氧气于铜屑与稀硝酸的体系中制取:
通氧气于铜屑与稀硝酸的体系中制取:![]()
甲同学认为三种方案的反应都可以在铁制容器中进行,乙同学认为______![]() 填“可行”“不可行”
填“可行”“不可行”![]() ,理由是
,理由是![]() 用一个化学方程式表示
用一个化学方程式表示![]() ______
______![]() 从环境保护和经济效益角度考虑,制取大量的硝酸铜最宜采用以上方法______,理由是_________.
从环境保护和经济效益角度考虑,制取大量的硝酸铜最宜采用以上方法______,理由是_________.
![]() 硝酸铜的性质研究
硝酸铜的性质研究
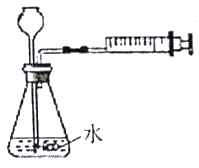
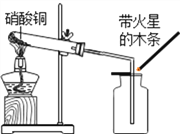
硝酸铜为蓝色固体,溶于水可得蓝色溶液![]() 该小组同学用如图装置加热硝酸铜,发现固体由蓝色逐渐变黑,同时产生红棕色有刺激性气味的气体,带火星的木条复燃.
该小组同学用如图装置加热硝酸铜,发现固体由蓝色逐渐变黑,同时产生红棕色有刺激性气味的气体,带火星的木条复燃.
【提出问题】硝酸铜在加热条件下到底发生了怎样的反应?
【查阅资料】
![]() 氧化铜和稀硫酸反应的化学方程式:
氧化铜和稀硫酸反应的化学方程式:![]()
![]() 含氮化合物中,只有
含氮化合物中,只有![]() 是红棕色、有刺激性气味的气体.
是红棕色、有刺激性气味的气体.
![]() 有助燃性,能使带火星的木条复燃
有助燃性,能使带火星的木条复燃
【猜想假设】
![]() 受热分解除了生成______,还可能生成了CuO和
受热分解除了生成______,还可能生成了CuO和![]() .
.
【进行实验】
实验操作 | 实验现象 | 实验结论 |
步骤I:将反应后试管中的固体加水充分溶解,过滤, ______ ,加热 | 固体全部溶解,得到蓝色溶液 | 硝酸铜分解生成了氧化铜. |
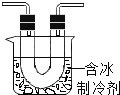
步骤II:在如图的试管和集气瓶之间连上此图所示的装置,重新进行加热硝酸铜的实验 | 集气瓶中气体为无色,______ | 硝酸铜分解生成了氧气 |
步骤II是同学们查阅了新的资料后设计完成的![]() 该资料是关于
该资料是关于![]() ______方面的性质信息.
______方面的性质信息.
【获得结论】根据实验结果,![]() 受热分解的化学方程式为______.
受热分解的化学方程式为______.
该小组同学取10g的硝酸铜加热一段时间后,测得剩余固体的质量为![]() ,则硝酸铜的分解率为______?
,则硝酸铜的分解率为______?![]() 分解率为已分解的硝酸铜占原硝酸铜的质量分数,写出计算过程
分解率为已分解的硝酸铜占原硝酸铜的质量分数,写出计算过程![]()
【反思与评价】
已知相同状况下,气体的体积比等于其分子个数比![]() 据此,同学们认为,即使没有资料
据此,同学们认为,即使没有资料![]() ,依据实验结论和“加热硝酸铜产生的气体能使带火星的木条复燃”的实验现象,也能推出
,依据实验结论和“加热硝酸铜产生的气体能使带火星的木条复燃”的实验现象,也能推出![]() 可能具有助燃性
可能具有助燃性![]() 理由是______.
理由是______.