题目内容
【题目】下表是KCl和KNO3在不同温度下的溶解度。
温度 / ℃ | 20 | 30 | 40 | 50 | |
溶解度(g/100g水) | KCl | 34.0 | 37.0 | 40.0 | 42.6 |
KNO3 | 31.6 | 45.8 | 63.9 | 85.5 | |
①硝酸钾的溶解度随温度的升高而 (7) (填“增大”或“减小”)。
②用同一种方法可以使KCl、KNO3二种物质的溶液都析出晶体,该方法是 (8) 。
③ KCl、KNO3两种物质溶解度相等的温度在 (9) 之间(用编号表示)
A.20℃以下 B.20℃~30℃ C.30℃~40℃ D.40℃~50℃
④20℃时,100g水中最多可溶解KCl (10) g;40℃时,将70g KCl的饱和溶液稀释成质量分数为20%的溶液,需加水 (11) g。
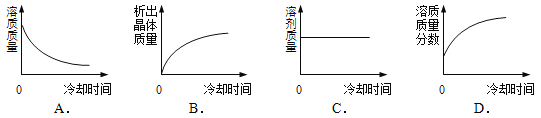
⑤将某温度下热的硝酸钾饱和溶液逐渐冷却至室温,下列有关量随时间变化趋势的图像不正确的是 (12) (用编号表示)
⑥实验设计:将不饱和氯化钾溶液变为饱和溶液
实验步骤 | 实验现象 | 实验结论 |
向不饱和的氯化钾溶液 中不断加入氯化钾固体 | (13) | KCl不饱和溶液 变为饱和溶液 |
【答案】(7)增大(8)蒸发结晶(或蒸发水)(9)B④(10)34 (11)30⑤(12)D⑥(13)有固体不再溶解
【解析】
试题分析:由表可知,硝酸钾的溶解度随温度的升高而增大KCl和KNO3的溶解度随着温度的升高而增大,要使用同种方法使KCl和KNO3都析出晶体,可采用蒸发结晶或蒸发水的方法由表可知,KCl在20℃~30℃之间溶解度为34.0~37.0,KNO3在20℃~30℃的溶解度为31.6~45.8,俩种溶解度会相等;④20℃时KCl的溶解度为34.0g/100g水,所以最多溶解KCl34g,40℃时KCl的溶解度为40g/100g水,则70gKCl中:(100+40)/40=70/溶质的质量,溶质的质量m=2800/140=20g,设需加入xg水,则20=0.2(70+x),x=30g,需加入水30g。⑤硝酸钾的溶解度随温度的升高而增大,将某温度下热的硝酸钾饱和溶液逐渐冷却至室温,随着冷却时间的增长,溶剂的质量肯定不会改变,故C项正确,而析出晶体的质量会逐渐增多,故B项正确,则溶质的质量会逐渐降低,故A项正确,又因为溶剂的质量不变,所以溶质的质量分数会逐渐降低,⑥向不饱和氯化钾溶液中不断加入氯化钾固体,当有固体不再溶解时,KCl会由不饱和溶液变成不饱和溶液,若还在继续溶解,则表示还处于不饱和溶液,故应填有固体不再溶解。

 金钥匙试卷系列答案
金钥匙试卷系列答案