题目内容
【题目】材料是人类发展中的重要物质,陶瓷属于
A.合成材料 B.无机非金属材料
C.复合材料 D.金属材料
【答案】B
【解析】
试题分析:陶瓷属于无机非金属材料,故选B

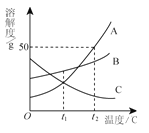
【题目】下表是KCl和KNO3在不同温度下的溶解度。
温度 / ℃ | 20 | 30 | 40 | 50 | |
溶解度(g/100g水) | KCl | 34.0 | 37.0 | 40.0 | 42.6 |
KNO3 | 31.6 | 45.8 | 63.9 | 85.5 | |
①硝酸钾的溶解度随温度的升高而 (7) (填“增大”或“减小”)。
②用同一种方法可以使KCl、KNO3二种物质的溶液都析出晶体,该方法是 (8) 。
③ KCl、KNO3两种物质溶解度相等的温度在 (9) 之间(用编号表示)
A.20℃以下 B.20℃~30℃ C.30℃~40℃ D.40℃~50℃
④20℃时,100g水中最多可溶解KCl (10) g;40℃时,将70g KCl的饱和溶液稀释成质量分数为20%的溶液,需加水 (11) g。
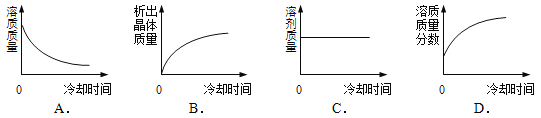
⑤将某温度下热的硝酸钾饱和溶液逐渐冷却至室温,下列有关量随时间变化趋势的图像不正确的是 (12) (用编号表示)
⑥实验设计:将不饱和氯化钾溶液变为饱和溶液
实验步骤 | 实验现象 | 实验结论 |
向不饱和的氯化钾溶液 中不断加入氯化钾固体 | (13) | KCl不饱和溶液 变为饱和溶液 |
【题目】深冷法的原理是先将空气液化,再利用氮气和氧气沸点的差异进行分离。
已知:常压下,氧气的沸点是-183℃,氮气的沸点是-196℃。
(1)分离时,氮气和氧气的状态是 (填序号)。
A | B | C | D | |
氧气 | 液态 | 液态 | 气态 | 气态 |
氮气 | 液态 | 气态 | 液态 | 气态 |
(2)制取得到的氧气可以用于 。
【题目】有一包白色粉末,可能由CuSO4、Na2SO4、Na2CO3、BaCl2、NaOH中的一种或几种组成。为探究其组成(友情提示:NaCl、BaCl2溶液呈中性),进行了以下实验:

请分析实验过程,回答下列问题:
(1)白色粉末中一定不含 。可能含有 。
(2)生成白色沉淀的化学方程式为 。
(3)无色滤液中呈碱性的物质可能含有Na2CO3;NaOH;NaOH和Na2CO3。
实验证明如下:
实验步骤 | 实验现象 | 实验结论 |
①取无色滤液少许于试管中,滴加过量的BaCl2溶液 | 产生白色沉淀 | 无色滤液中含有 |
②在①反应后的试管中滴加 | 溶液变为红色 | 无色滤液中含有Na2CO3、NaOH |
(4)白色粉末的成分是 。
【题目】已知氯酸钾(KClO3)固体在二氧化锰作催化剂,在加热的条件下也可制得氧气,同时生成氯化钾(KCl)固体。写出该反应的化学方程式: ,该反应的基本类型是 。
小芳发现,氯酸钾与氧化铜混合加热,也能较快产生氧气,于是进行如下探究:
【提出猜想】除MnO2、CuO外,Fe2O3也可以作KClO3分解的催化剂。
【进行实验】按如表进行实验,并测定分解温度(分解温度越低,催化效果越好).
实验编号 | 实验药品 | 分解温度(℃) |
① | K KClO3 | 5 580 |
② | K KClO3、MnO2(质量比1:1) | 3 350 |
③ | K KClO3、CuO(质量比1:1) | |
④ | K KClO3、Fe2O3(质量比1:1) | 3 390 |
【分析数据、得出结论】
(1)由实验 与实验④对比,证明猜想合理;
(2)实验所用的三种金属氧化物比较,氧化铜催化效果仅次于二氧化锰,请你推出其分解温度(用t表示)的取值范围: ;
【交流反思】
(3)若要证明Fe2O3是该反应的催化剂,还要验证它在化学反应前后的 和
不变;
(4)影响氯酸钾分解快慢除催化剂种类外,你认为还可能有的影响因素是
(写出一种即可)。