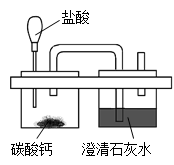
题目内容
(6分) 某实验小组同学为测定一瓶久置过氧化氢溶液的溶质质量分数,进行了如下操作:取该溶液34克于烧杯中,加入1克二氧化锰完全反应后,称得烧杯内剩余物质的总质量为33.4克。试计算:
(1) 反应后生成氧气的质量;
(2)所取溶液中溶质的质量;
(3)该瓶过氧化氢溶液的溶质质量分数。
(1) 反应后生成氧气的质量;
(2)所取溶液中溶质的质量;
(3)该瓶过氧化氢溶液的溶质质量分数。
(1)1.6g (2)3.4g (3)10%
溶液减少的质量就是生成氧气的质量;
由生成氧气和所取过氧化氢溶液的质量根据过氧化氢分解的化学方程式可以计算出瓶内过氧化氢溶液中溶质的质量分数
解:(1)根据质量守恒定律,生成氧气的质量为34g+1g-33.4g=1.6g………………1分
(2)设所取溶液中溶质的质量为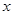 。
。
2H2O2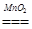 2H2O+O2↑…………………………1分
2H2O+O2↑…………………………1分
2×34 32
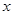 1.6g ----------------------------1分
1.6g ----------------------------1分
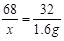
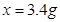 ………………………………1分
………………………………1分
(3)该瓶过氧化氢溶液的溶质质量分数=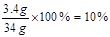 …… 2分
…… 2分
答:⑴生成氧气的质量为1.6g。(2)所取溶液中溶质的质量为3.4g
(3) 该瓶过氧化氢溶液的溶质质量分数为10%。
由生成氧气和所取过氧化氢溶液的质量根据过氧化氢分解的化学方程式可以计算出瓶内过氧化氢溶液中溶质的质量分数
解:(1)根据质量守恒定律,生成氧气的质量为34g+1g-33.4g=1.6g………………1分
(2)设所取溶液中溶质的质量为
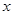 。
。2H2O2
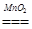 2H2O+O2↑…………………………1分
2H2O+O2↑…………………………1分2×34 32
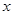 1.6g ----------------------------1分
1.6g ----------------------------1分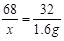
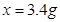 ………………………………1分
………………………………1分(3)该瓶过氧化氢溶液的溶质质量分数=
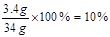 …… 2分
…… 2分答:⑴生成氧气的质量为1.6g。(2)所取溶液中溶质的质量为3.4g
(3) 该瓶过氧化氢溶液的溶质质量分数为10%。

练习册系列答案
 心算口算巧算一课一练系列答案
心算口算巧算一课一练系列答案 应用题作业本系列答案
应用题作业本系列答案
相关题目