题目内容
【题目】绿矾(FeSO47H2O),又称绛矾,始载于《新修本草》“矾石有五种……其绛矾本来绿色,新出窟未见风者,正如琉璃……烧之赤色,故名绛矾矣”。绿矾在医药、净水、化肥、农药等方面有广发的应用。某学习小组进行了如下学习活动:
Ⅰ.制备FeSO4。
(1)请你写出一个以Fe为原料制备FeSO4的化学方程式_________,若有5.6 g Fe完全反应,理论上生成FeSO4_______g。
Ⅱ.小组同学在用绿矾配制FeSO4溶液时发现,溶液颜色会由绿变黄。然后进行如下探究:
(查阅资料)
ⅰ.FeSO4溶液能与氧气反应,反应生成的可溶性含铁物质遇KSCN溶液会变红。
ⅱ.保存FeSO4溶液时要加入稀硫酸和铁钉,置于阴凉处。
(提出猜想)
影响FeSO4溶液与氧气反应速率的因素可能有温度、浓度、溶液酸碱性、是否有铁钉等。
(进行实验)
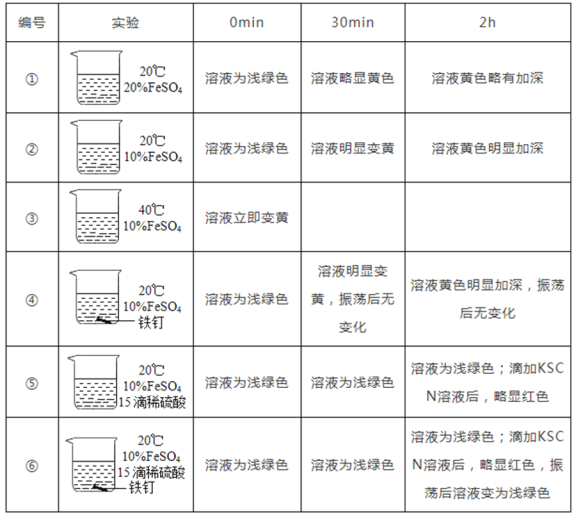
(解释与结论)
(2)通过对比实验②和③,得出的结论是 _____ 。
(3)欲得出“稀硫酸和铁钉共同存在下才能有效防止FeSO4溶液变质”的结论,需要对比_____ (填编号)。
(4)实验⑤中,FeSO4溶液变质的反应如下,补全该反应的化学方程式。4FeSO4 + 2H2SO4+ O2 2Fe2(SO4)3 + _____ _______
(5)下列说法正确的是 _____ .
A.其他条件相同,溶液酸性增强,FeSO4溶液变质加快
B.其他条件相同,FeSO4溶液浓度越大,变质越快
C.实验⑥中,滴加KSCN溶液后,略显红色,振荡后溶液变为浅绿色,可能是发生了反应Fe2(SO4)3 +Fe=3FeSO4
D.“其绛矾本来绿色……烧之赤色”,颜色发生变化的原因可能是铁的化合价发生了变化
【答案】Fe + H2SO4====FeSO4 + H2↑ 或Fe + CuSO4====FeSO4 + Cu15.2温度越高,FeSO4溶液与氧气反应的速率越快;或者温度会影响FeSO4溶液与氧气反应的速率②④⑤⑥2H2OCD
【解析】
解:I(1)据质量守恒,由Fe生成FeSO4,需要增加SO42-,所以可以用含有SO42-的溶液如H2SO4或CuSO4,故化学方程式为:Fe+H2SO4═FeSO4+H2↑或Fe+CuSO4═FeSO4+Cu;设5.6gFe反应生成FeSO4的质量为x,由题意得:
Fe~FeSO4
56 152
5.6g x
![]()
x=15.2g;【解释与结论】本题主要利用化学实验中的控制变量法来完成:(2)对比实验②③,发现③的温度高为40℃,在0min溶液立即变为黄色,说明温度越高,FeSO4溶液与氧气反应的速率越快;或者温度会影响FeSO4溶液与氧气反应的速率,故答案为:温度越高,FeSO4溶液与氧气反应的速率越快;或者温度会影响FeSO4溶液与氧气反应的速率;(3)要验证FeSO4变质,需要外部条件一样,所以需要20℃,用实验②做对比,过2h溶液颜色变黄加深,说明已经氧化;实验④是只有铁钉,过2h溶液颜色变黄加深,说明已经氧化;实验⑤是只有H2SO4,过2h后滴加KSCN溶液后,略显红色,说明已氧化;实验⑥铁钉和H2SO4都有,过2h后振荡后溶液变为浅绿色,说明没有氧化。综合以上分析,说明FeSO4要不变质,氧化,需要稀硫酸和铁钉共同存在下;(4)根据质量守恒中反应前后原子个数和种类不变,发现反应后少4个氢原子和2个氧原子。所以为2H2O;(5)选项A B 根据实验②和①,烧杯内H2SO4浓度有10%提高到20%,浓度变大,溶液酸性增强,现象为30min溶液鲜黄色到略显黄色,说明酸性增强,溶液变质速度慢,故A B错;选项C 溶液变黄是因为生产了Fe3+,而溶液有变为浅绿色是生成了Fe2+,因为实验⑥中有铁钉,所以会发生反应:Fe2(SO4)3+Fe═3FeSO4,故C对;选项D 因为Fe2+溶液为浅绿色,Fe3+溶液为黄色,所以有变化,是Fe的化合价变了,故D对。