��Ŀ����
����Ŀ��������ijλͬѧ�Խ�ѧϰ���й����ݵĹ��ɣ���ͬѧ������ȷ�ĸ���Ϊ��������
��C��12ԭ�Ӻ�C��13ԭ�Ӳ�ͬ��ԭ�������ǵĺ�������������ͬ��
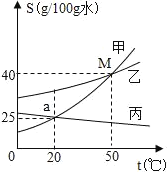
��������������Ӣ�����������Խ���ʾ��������Խ�ã�
��KMnO4��K2MnO4�к�����ͬ��ԭ���ţ�
��ȼ����Ҫͬʱ�����������������ƻ�����һ�������Ϳ������
��̼�������ᷴӦ���������ɣ������ᷴӦ���������һ����̼���Σ�
���кͷ�Ӧһ�������κ�ˮ���������κ�ˮ�ķ�Ӧ��һ�����кͷ�Ӧ
��������Һ��ʹ��̪��Һ��죬����ʹ��̪��Һ����һ���Ǽ�����Һ
��ij��������5.6g��������ϡ�����ַ�Ӧ������0.21g�����������л��еĽ���������Zn
A. 2��B. 3��C. 4��D. 5��
���𰸡�B
��������
��C��12ԭ�Ӻ�C��13ԭ�Ӳ�ͬ��ԭ�������ǵĺ�������������ͬ����˵������
�ڿ�����������Ӣ�����������Խ���ʾ��������Խ���˵������
��KMnO4�к��е��Ǹ��������K2MnO4�к��е��������������ͬ��ԭ���ţ���˵������
��ȼ����Ҫͬʱ�����������������ƻ�����һ�������Ϳ�����𣬹�˵����ȷ��
�������ᷴӦ������������ʿ�����̼���Σ�Ҳ�п����ǻ��õĽ�������˵������
���кͷ�Ӧһ�������κ�ˮ�������κ�ˮ�ķ�Ӧ��һ�����кͷ�Ӧ������������������ķ�Ӧ�����кͷ�Ӧ����˵����ȷ��
������Һ��ʹ��̪��Һ��죬����ʹ��̪��Һ����һ���Ǽ�����Һ����˵����ȷ��
����5.6g����������ϡ�����ַ�Ӧ��������������ΪX��
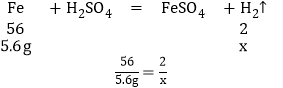
���X��0.2g
��5.6gп��������ϡ�����ַ�Ӧ��������������ΪY��
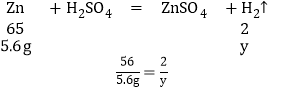
���Y�T0.17g��
�����ϼ����֪����5.6g����������ϡ���ᷴӦʱ�ܹ�����0.2g��������5.6g��п������ϡ���ᷴӦʱ�ܹ�����0.17g������
�ɴ˿�֪����������5.6g��������ϡ�����ַ�Ӧ������0.21g�����������л��еĽ�����������п����˵������
��ѡ��B��

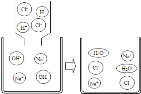
����Ŀ����ѧѧ��ʵ������ϣ���ʦ����һ����ĩ�������ɳ��ڷ����ڿ����е����ۺ;��õļ�ʯ�Ҹ������϶��ɣ���ͬѧ�����ʵ�����̽����
��������⣩������Ʒ�ijɷ���ʲô��
���������ϣ���1����ʯ�Ҹ������CaO��NaOH�Ļ���
��2��BaCl2��Һ�����ԡ�
����������裩������Ʒ�п��ܺ��� Fe��Fe2O3��CaO��NaOH��Ca��OH��2��Na2CO3��_____���������ʡ�
������ʵ�飩
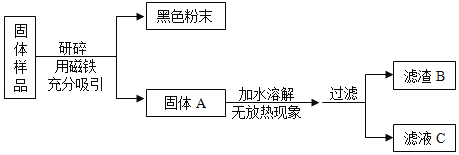
����ͬѧ������B�ijɷֽ���̽������¼���£�
ʵ����� | ʵ������ | ʵ����ۼ���ѧ����ʽ |
ȡ��������B���Թ��У���������ϡ���ᣬ�����ɵ�����ͨ������ʯ��ˮ�� | ��_____ ��_____ | ���ۣ�����B���� Fe2O3��CaCO3��ʵ������з�Ӧ�Ļ�ѧ����ʽΪ��_____�����һ�����ɣ� |
����ͬѧ����ҺC�ijɷֽ���̽������¼���£�
ʵ����� | ʵ������ | ʵ����� |
ȡ������ҺC���Թ��У��������BaCl2��Һ�����ã����ϲ���Һ�еμ���ɫ��̪��Һ���� | ���а�ɫ�������� �ڷ�̪��Һ����ɫ��ɺ�ɫ | ��ҺC����_____ |
����������ۣ���1������ͬѧʵ���м������BaCl2��Һ��Ŀ����_____��
��2��ͨ������ʵ��̽�����ù�����Ʒ����ȷ��һ�����еijɷ���_____��