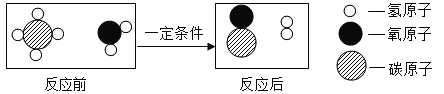
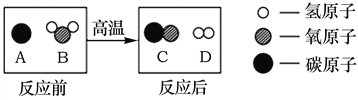
��Ŀ����
����Ŀ�����к�������Դ��̽���������ú���Դ�Թ��Ҿ��ý��������ش�ij��ȤС���ͬѧ�������ϲ�ɽ����ʯ���ҽ�����ɷ�����ȡ��Ʒ50gƽ���ֳ����ݣ�һ���ô��С��������һ��Ϊ�������Ȼ��ֱ�ͬʱͶ�뵽��ʢ��150gij������������ϡ������ձ���(�ձ�������75g)����ʼ��ʱ�������ٲ�������Ϊֹ(��Ӧ��������ʣ��)����¼ʱ��Ϊ100S��230S������Ӧ��ļ��ձ��ŵ�������ƽ�ϳ�����������������241.2g(�����ձ���������ˮ��������ȣ����ʸ�ϡ�����Ӧ)����������ش��������⣺
(1)��ʯ��ʯ�ô�ɿ�����Ŀ����______________�����ձ��еķ�Ӧʱ����_________S����Ӧ��������ձ���������ӦΪ________g��
(2)���ձ����ܹ�����������̼��������_________g��(����ֱ����д���)
(3)�����ʯ��ʯ��Ʒ��̼��ƵĴ���(��ʯ��ʯ��̼��Ƶ���������)Ϊ_______��
���𰸡� ����ʯ��ʯ��ϡ����ĽӴ�������ӿ췴Ӧ���� 100 241.2 8.8 80%
��������(1)��������ʯ��ʯ��ϡ����ĽӴ�������ӿ췴Ӧ���ʼ�������Ϣ�������(2)���������غ㶨�ɼ�����(3)���ݷ�Ӧ�Ļ�ѧ����ʽ������(1)��ʯ��ʯ�ô�ɿ�����Ŀ��������ʯ��ʯ��ϡ����ĽӴ�������ӿ췴Ӧ���ʣ���������Ϣ��֪�����ձ�����С����ʯ��ʯ�����ᷴӦ����Ӧ���ʽϿ죬�ʼ��ձ��еķ�Ӧʱ����100S�����ձ������ձ�������������ʯ��ʯ���������ձ���������ȫ��ȣ�ֻ�Ƿ�Ӧ���ʲ�ͬ���ʷ�Ӧ��������ձ���������ӦΪ241.2g��(2)���ձ����ܹ�����������̼��������150g+75g+��50g��2��-241.2g=8.8g��(3)����Ʒ��̼��Ƶ�����Ϊx��
CaCO3+2HCl=CaCl2+H2O+CO2��
100 44
x 8.8g
![]()
x=20g
ʯ��ʯ��̼��Ƶ���������=![]() ��100��=80��
��100��=80��
��ʯ��ʯ��̼��Ƶ���������Ϊ80����