题目内容
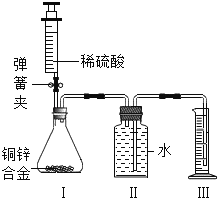
【题目】化学是以实验为基础的学科,根据图l、图2、图3;如图回答下列问题:配置100g溶质质量分数为16%的氯化钠溶液.实验操作如下:

(1)称量氯化钠固体的质量:所选砝码为_____、游码的示数为_____.
(2)量取水的体积:用量筒量取_____mL水(ρ水≈1g/cm3).
(3)溶解:用到的玻璃仪器是烧杯、玻璃棒.
(4)装瓶、贴标签:在如图的标签中应填上的内容是_____.
【答案】10g和5g 1g 84 NaCl溶液;16%
【解析】
(1)氯化钠固体的质量=100g×16%=16g;由提供的砝码可知,砝码选择10g和5g的,游码拨到1g处;故填:10g和5g;1g;
(2)水的质量=100g﹣16g=84g,水的体积为:84g÷1g/cm3=84cm3=84mL;故填:84;
(4)试剂瓶标签上应标注溶液的名称及其溶质的质量分数.故填:NaCl溶液;16%.

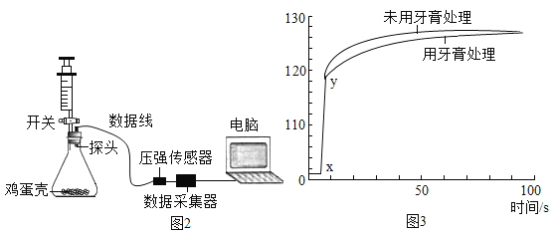
【题目】小明对铁的锈蚀进行如下探究,室温时,将包有样品的滤纸包用大头针固定在橡胶塞上,迅速塞紧,装置如图,观察到量筒内水沿导管慢慢进入广口瓶(净容积为146mL)。当温度恢复至室温,且量筒内水面高度不变时读数(此时瓶内氧气含量近似为零)。记录起始和最终量筒的读数以及所需时间如表。
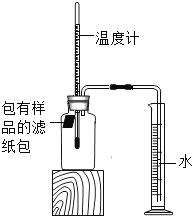
序号 | 样品 | 量筒起始 读数/mL | 量筒最终 读数/mL | 所需时间 /min |
1 | 1g铁粉、0.2g碳和10滴水 | 100 | 70 | 约120 |
2 | lg铁粉、0.2g碳、10滴水和少量NaCl | 100 | 70 | 约70 |
3 | …… | 100 | 70 | 约480 |
(1)实验①和②说明NaCl可以_____铁锈蚀的速率。
(2)实验开始后,广口瓶内温度有所上升,说明铁的锈蚀过程是_____(填“放热”或“吸热”)过程。
(3)实验结束后取出滤纸包,观察到有红棕色物质生成,该物质的化学式是_____。
(4)已知含碳能够加快铁的生锈速度,小明想通过实验①和③是探究碳对铁锈蚀速率的影响,请在表格空白处填写实验③的样品组成_____。
(5)该装置还可用于测量空气中氧气的含量,根据上述数据计算氧气的体积含量是_____(小数点后保留1位)。
【题目】(6分)某校同学开展了如下“溶液酸碱性的检验”的实验活动:

(1)把自制的紫色紫薯汁按图1所示分别滴加到试管中,观察到的现象如下表所示:
溶液 | 白醋 | 盐酸 | 蔗糖水 | 草木灰水 | 石灰水 |
加入紫薯汁后的颜色 | 红色 | 红色 | 紫色 | 绿色 | 绿色 |
①图1中存放紫薯汁的仪器名称 ;
②据上表推测,紫薯汁能做酸碱指示剂,遇到稀硫酸溶液可能显示的颜色是 ;
(2)用PH试纸测定图1中部分溶液的酸碱度:草木灰水pH>7,属于 (填“酸性”“中性”或“碱性”)溶液,白醋pH (填“>””<”或”=”)7;
(3)图2是三位同学分别测定土壤酸碱度的操作示意图,其中正确的是 (填“A”“B”或“C”,下同),可能导致北侧溶液pH数值发生改变的错误操作是 。
【题目】同学们在帮老师整理实验室时,发现石灰水试剂瓶瓶壁和瓶塞周围有一些白色粉末.为了弄清楚白色粉末的成分及形成原因,他们进行了如下探究:
(资料)①表是几种物质常温时的溶剂能力
②酚酞试剂遇碱性溶液变红色:石灰水溶液显碱性
OH﹣ | Cl﹣ | CO32﹣ | NO3﹣ | |
Ca2+ | 微 | 溶 | 不 | 溶 |
(1)对白色粉末成分的猜想和成因
白色粉末的成分 | 形成的原因 |
可能是CaCO3 | 反应的化学方程式为:_____ |
可能是Ca(OH)2 | 暑假气温较高,溶质的溶解度降低或溶剂蒸发,石灰水中的溶质结晶析出 |
经过反复思考,同学们认为白色粉末还可能是二者的混合物.
(2)设计实验:甲同学取白色粉末装入试管中,加入少量水震荡,发现有白色固体不溶解,于是他得出粉末中一定有CaCO3,有人认为甲同学的结论不严密,理由是_____.为了得出较严密的结论,他们进行了如下实验,请完成下列实验报告:
实验步骤 | 可能观察到的现象 | 结论 |
取上述试管中的上次清夜,滴加1~2滴无色酚酞试液 | _____ | _____ |
向上述试管中的残留固体中加入稀盐酸 | _____ | 白色粉末_____(“有”或“无”)CaCO3 |
由上述实验可知白色粉末的成分是:_____. | ||
(3)实际应用:向盛有碳酸钙粉末的试管中加入足量的稀盐酸,完全反应后共收集到4.4g二氧化碳气体,试计算反应消耗的碳酸钙的质量_____.