题目内容
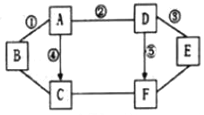
【题目】用以下装置探究碳及其氧化物的某些性质。

(1)写出仪器①的名称_____。
(2)写出 A 中反应的化学方程式_____。
(3)C 装置利用了浓硫酸的_____性。
(4)D 装置中玻璃管内反应的化学方程式为_____。
(5)F 装置除了吸收 CO2 外,还可以起到的作用是_____。
(6)在实验过程中,一氧化碳和氧化铜反应不仅能生成铜,还可能生成少量氧化亚铜(化 学式为 Cu2O)。如果实验前在 E 中放入氧化铜的质量为 2.0g,氧化铜全部反应完后,E 中固体质量可能为_____(填字母)。
A 1.55g B 1.60g C 1.65g D 1.82g
【答案】长颈漏斗 CaCO3+2HCl=CaCl2+H2O+CO2↑ 吸水 C+CO2![]() 2CO 收集CO BC
2CO 收集CO BC
【解析】
(1)仪器①的名称是长颈漏斗;
(2)大理石的主要成分是碳酸钙,碳酸钙和稀盐酸反应生成氯化钙、水和二氧化碳,方程式为:CaCO3+2HCl=CaCl2+H2O+CO2↑
(3)由于反应是在溶液中进行,制的气体中含有水蒸气,浓硫酸具有吸水性,可以吸收气体中的水分;
(4)通过ABC装置得到纯净的二氧化碳,二氧化碳和碳在高温下生成一氧化碳,方程式为:C+CO2高温2CO;
(5)F装置除了吸收CO2外,还可以起到的作用是收集一氧化碳;
(6)设全部生成铜时质量为x
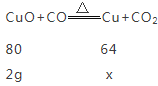
![]()
X=1.6g
设全部生成氧化亚铜时质量为y
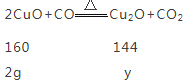
![]()
y=1.8g
因此生成固体的质量1.8g>m>1.6g
因此选BC。

【题目】乙醇俗称酒精,可用作医用消毒,也常作燃料。其完全燃烧的化学方程式可表示为:C2H6O+3O2![]() 2 CO2+ 3 H2O 。
2 CO2+ 3 H2O 。
23g乙醇完全燃烧需消耗多少克氧气?
乙醇不完全燃烧会产生一氧化碳,某实验测得反应前后各物质的质量如下表:
物质 | 乙醇 | 氧气 | 二氧化碳 | 水 | 一氧化碳 |
反应前质量(g) | 4.6 | 8.8 | 0 | 0 | 0 |
反应后质量(g) | 0 | 0 | 6.6 | 5.4 | a |
①表中a的值为____ __。
②该实验发生反应的化学方程式为:4C2H6O+11O2![]() _____ CO2+ _____ H2O + _____ CO 。
_____ CO2+ _____ H2O + _____ CO 。