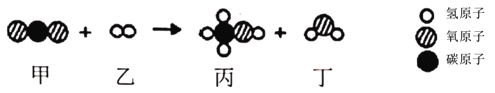
题目内容
【题目】二氧化碳是很重要的化工原料,科学家设想利用太阳能加热器“捕捉CO2”、“释放CO2”,实现碳循环。
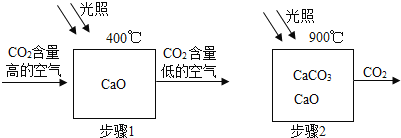
①步骤2的化学方程式为__________。
②为确定步骤2中的碳酸钙是否完全分解,设计的实验步骤为:取少量固体于试管中,滴加过量_______溶液,若观察到试管内_______,则分解不完全。
③上述设想的优点有_______(填字母序号)。
A原料易得且可循环利用B充分利用太阳能C可全地域全天候使用
④CO2是宝贵的碳氧资源。CO2和H2在一定条件下可合成甲酸(HCOOH),此反应中CO2与H2反应的化学方程式为_______,若要测定1%甲酸水溶液酸碱度,选用_______(填字母序号)测定。
A无色酚酞溶液 B紫色石蕊溶液 CpH试纸
【答案】![]() 稀盐酸 产生气泡 AB
稀盐酸 产生气泡 AB  C
C
【解析】
①由图可知,步骤2为碳酸钙在900℃和高温的条件下反应生成氧化钙和二氧化碳,该反应的化学方程式为:![]() ;
;
② 碳酸钙能与稀盐酸反应生成氯化钙、二氧化碳和水,故为确定步骤2中的碳酸钙是否完全分解,设计的实验步骤为:取少量固体于试管中,滴加过量稀盐酸溶液,若观察到试管内有气泡产生,则分解不完全;
③A、由图可知,上述设想的原料是氧化钙和二氧化碳,比较容易得到,且氧化钙和二氧化碳既是反应物,又是生成物,可以循环利用,符合题意;
B、由图可知,该设想的反应需要光照,故可充分利用太阳能,符合题意;
C、由图可知,该设想需要光照,黑暗处及阳光不充足处不能使用,不符合题意。
故选AB;
④CO2和H2在一定条件下可合成甲酸(HCOOH),该反应的化学方程式为: ;
;
测定酸碱度要用pH试纸,酸碱指示剂只能测定溶液的酸碱性。
故选C。

练习册系列答案
 全能测控一本好卷系列答案
全能测控一本好卷系列答案
相关题目