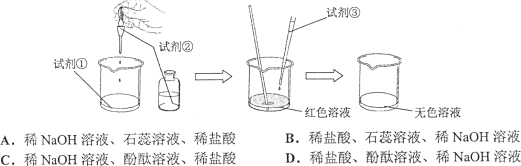
题目内容
【题目】有一包白色固体,可能含有Ba(NO3)2、NaCl、CaCO3、Na2SO4,NaOH、CuSO4中的一种或几种。为确定其组成,进行下列实验。请根据实验现象判断:
①取样,溶于足量水中,搅拌、过滤,得到无色澄清溶液A和14.9g沉淀B。
②向14.9g沉淀B中加过量稀HNO3.沉淀全部溶解。有气泡产生并测得气体质量为 4.4g,同时得到蓝色溶液。在澄清溶液A中,加足量 BaCl2溶液,经过滤、洗涤、干燥,得固体23.3g。
(1)此固体中一定含______,一定不含______,可能含有______。
(2)得到蓝色溶液化学方程式为______。
(3)为确定原固体中可能含有的物质,测定溶液A的pH>7,取少量溶液A,先加入足量__溶液,过滤,在滤液中加入足量的稀硝酸后,再滴加__溶液,根据现象即可判断。
【答案】Na2SO4 、CaCO3、NaOH、CuSO4 Ba(NO3)2 NaCl ![]() Ba(NO3)2 AgNO3
Ba(NO3)2 AgNO3
【解析】
①取样,溶于足量水中,搅拌、过滤,得到无色澄清溶液A和14.9g沉淀B,有沉淀生成,且沉淀颜色未知,能形成沉淀的可能是碳酸钙、硝酸钡与硫酸钠反应生成的硫酸钡,也可能是硫酸铜与氢氧化钠反应生成的氢氧化铜,且硫酸铜完全转化为沉淀,,因为得到无色澄清溶液,沉淀B可能是这些沉淀中的一种,也可能是它们的混合物;
②向14.9g沉淀B中加过量稀HNO3.沉淀全部溶解。沉淀全部溶解,说明沉淀不含硫酸钡,因为硫酸钡与稀硝酸不反应,有气泡产生并测得气体质量为 4.4g,说明沉淀含碳酸钙,碳酸钙与稀硝酸反应生成二氧化碳气体,同时得到蓝色溶液,说明沉淀含氢氧化铜,氢氧化铜与稀硝酸反应生成硝酸铜和水,由此可得出,白色固体中一定含碳酸钙、氢氧化钠、硫酸铜,肯定不含硝酸钡,因为钡离子能与硫酸根离子结合形成硫酸钡沉淀;
已知,加入过量稀硝酸,产生二氧化碳的质量为4.4g,设白色固体中含碳酸钙的质量为x

![]() x=10g
x=10g
故生成氢氧化铜沉淀的质量为:14.9g-4.9g=4.9g;
设氢氧化钠与硫酸铜反应生成硫酸钠的质量为y
![]() y=7.1g
y=7.1g
在澄清溶液A中,加足量BaCl2溶液,经过滤、洗涤、干燥,得固体23.3g。得到的固体为溶液中的硫酸钠与氯化钡反应生成的硫酸钡沉淀,氢氧化钠与硫酸铜反应生成了硫酸钠,原白色固体中也可能含硫酸钠。
设生成23.3g硫酸钡沉淀,需要硫酸钠的质量为z

![]() z=14.2g
z=14.2g
已知氢氧化钠与硫酸铜反应生成了7.1g硫酸钠,故原白色固体中一定含有硫酸钠。无法确定是否含氯化钠。
(1)由分析可知,此固体中一定含Na2SO4 、CaCO3、NaOH、CuSO4,一定不含Ba(NO3)2,可能含有NaCl;
(2)得到蓝色溶液为氢氧化铜与稀硝酸反应生成硝酸铜和水,该反应的化学方程式为:![]() ;
;
(3)原固体中可能含有的物质是氯化钠,测定溶液A的pH>7,说明溶液A中含有氢氧化钠,由以上分析可知,溶液A中含有硫酸钠,应先除去硫酸钠和氢氧化钠,以防对氯化钠的检验产生干扰,故取少量溶液A,先加入足量硝酸钡溶液,使硝酸钡与硫酸钠反应生成硫酸钡和硝酸钠,将硫酸根离子除尽,过滤,在滤液中加入足量的稀硝酸,使氢氧化钠与稀硝酸反应生成硝酸钠和水,除去氢氧根离子,再滴加硝酸银溶液,硝酸银能与氯化钠反应生成氯化银白色沉淀,如果产生白色沉淀,说明含氯化钠,否则不含。故填:Ba(NO3)2;AgNO3。