题目内容
【题目】现有含CuSO4和H2SO4的混合溶液,向其中加入一定溶质质量分数的NaOH溶液,实验过程中,生成沉淀的质量与加入NaOH溶液的质量关系如图所示:
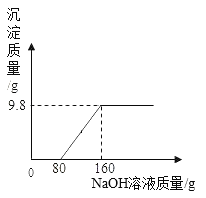
(1)恰好完全反应时,产生沉淀的质量 g。
(2)求混合液中CuSO4的质量 g。
(3)刚开始没有产生沉淀的原因 (用化学方程式表示);
(4)求该NaOH溶液的溶质质量分数(写计算过程)。
【答案】(1)9.8;(2)16;(3)2NaOH+H2SO4=Na2SO4+2H2O;(4)10%(详见解析)
【解析】
含CuSO4和H2SO4的混合溶液,向其中加入一定溶质质量分数的NaOH溶液,氢氧化钠先与稀硫酸反应,稀硫酸反应完毕后再与硫酸铜反应,根据生成的氢氧化铜的质量和对应的化学方程式求算消耗的硫酸铜的质量以及该NaOH溶液的溶质质量分数等。
(1)由图可知,生成的氢氧化铜的质量为9.8g;
(2)解:设混合液中CuSO4的质量为x,与硫酸铜反应NaOH的质量为y
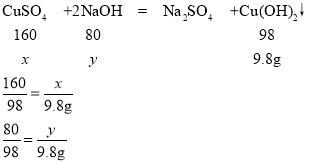
解得:x=16g y=8g
(3)刚开始没有产生沉淀的原因是加入的氢氧化钠与稀硫酸反应生成了硫酸钠和水,化学方程式为:2NaOH+H2SO4=Na2SO4+2H2O。
(4)该NaOH溶液的溶质质量分数为:![]() ×100%=10%
×100%=10%
答:该NaOH溶液的溶质质量分数为10%。
故答案为:(1)9.8。
(2)16。
(3)2NaOH+H2SO4=Na2SO4+2H2O。
(4)10%。

练习册系列答案
相关题目