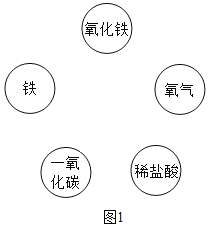
题目内容
【题目】工业上常采用Cu与稀盐酸在持续通入空气的条件下制取CuCl2。其原理如图所示。下列说法正确的是
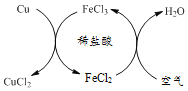
A.反应过程中需不断添加FeCl3溶液
B.该实验说明Cu能与稀盐酸发生置换反应
C.通入空气发生的反应为4FeCl2+O2+4HCl=4FeCl3+2H2O
D.若反应恰好完全进行,将3.2g的铜完全反应,需消耗10.0%的盐酸36.5g
【答案】CD
【解析】
A、由图可知,氯化铁在该流程中既是反应物,又是生成物,可以循环利用,不需要不断添加,不符合题意;
B、由图可以看出,铜先与氯化铁反应生成氯化亚铁和氯化铜,然后氯化亚铁与空气中的氧气、稀盐酸反应生成氯化铁,铜与稀盐酸并不能发生置换反应,不符合题意;
C、由图可以看出,通入空气发生的反应为氯化亚铁、氧气、稀盐酸反应生成氯化铁和水,该反应的化学方程式为:![]() ,符合题意;
,符合题意;
D、铜先与氯化铁反应生成氯化亚铁和氯化铜,![]() ,然后氯化亚铁与空气中的氧气、稀盐酸反应生成氯化铁,
,然后氯化亚铁与空气中的氧气、稀盐酸反应生成氯化铁,![]() ,故可得到关系式:
,故可得到关系式:![]() ,
,
设3.2g 铜消耗稀盐酸的质量为x。

![]() x=3.65g
x=3.65g
需消耗10.0%的盐酸的质量为:3.65g÷10%=36.5g。符合题意。
故选CD。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】为探究碳还原氧化铜的最佳实验条件,用木炭粉和氧化铜的干燥混合物12.5g进行系列实验。
(查阅资料)①氧化铜(CuO)为黑色固体。
②碳还原氧化铜得到的铜中可能含有少量的氧化亚铜;氧化亚铜为红色固体,能与稀硫酸反应:Cu2O+H2SO4═CuSO4+H2O+Cu。
(进行实验)
实验1:取一定量混合物,用如图所示装置进行多次试验,获得如下实验数据与现象。

序号 | 木炭粉与氧化铜的质量比 | 反应后物质的颜色、状态 | |
1 | 1:9 | 红色固体有金属光泽 | 混有少量黑色物质 |
2 | 1:10 | 混有很少量黑色物质 | |
3 | 1:11 | 混有极少量黑色物质 | |
4 | 1:12 | 无黑色物质 | |
5 | 1:13 | 混有较多黑色物质 |
(1)实验中,证明产生了CO2的现象是_____。
(2)该实验的结论是_____。
(反思与评价)
(3)实验2没有进行质量比为1:14的实验,理由是_____。
(4)为检验第4次实验的生成红色固体中是否含Cu2O,所需试剂是_____。