题目内容
【题目】某金属冶炼厂在生产过程中产生了一定量的含铜废料。化学兴趣小组利用稀硫酸和铁粉分离回收铜,并获得硫酸亚铁晶体。其设计方案如图所示。
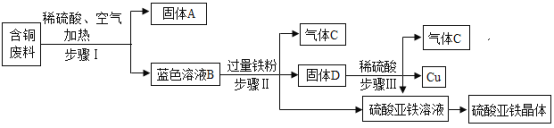
查阅资料得知:在通入空气并加热的条件下,铜可与稀硫酸反应转化为硫酸铜,反应的化学方程式:![]() 。
。
(1)步骤I中分离得到固体A和蓝色溶液B的操作名称是_______________。
(2)蓝色溶液B中的溶质是______________ (填化学式)。固体D的成分是_______________。
(3)写出步骤Ⅲ中发生反应的化学方程式_______________。硫酸亚铁溶液中可能含有的物质是_______________。
【答案】过滤 H2SO4和CuSO4 Cu和Fe ![]() H2SO4
H2SO4
【解析】
(1)步骤I中分离得到固体A和蓝色溶液B的操作名称是过滤;
(2)由题意可知,废料中的铜与氧气反应生成氧化铜,氧化铜与硫酸反应生成硫酸铜和水,所以蓝色溶液中的溶质中含有硫酸铜,根据蓝色溶液中加入铁有气体产生,说明蓝色溶液中含有过量的硫酸,所以溶质中还含有硫酸;加入铁粉是利用铁与硫酸铜反应生成铜和硫酸亚铁,将铜置换出来,得到硫酸亚铁,铁与硫酸反应生成硫酸亚铁和氢气,也是获得硫酸亚铁,所以加入略过量的铁粉,过量的目的是使CuSO4、H2SO4完全反应;固体D中含有剩余的铁和生成的铜;
(3)步骤Ⅲ中发生反应的是铁和硫酸生成硫酸亚铁和氢气,化学方程式Fe+ H2SO4 =FeSO4 + H2↑。如果铁和硫酸刚好完全反应,溶液中溶质只有硫酸亚铁;如硫酸过量,溶液中的溶质为硫酸亚铁和硫酸,故硫酸亚铁溶液中可能含有的物质是硫酸。

练习册系列答案
相关题目