题目内容
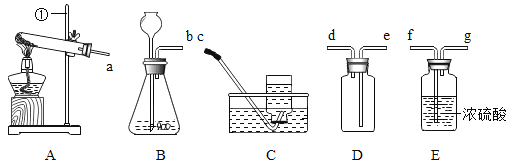
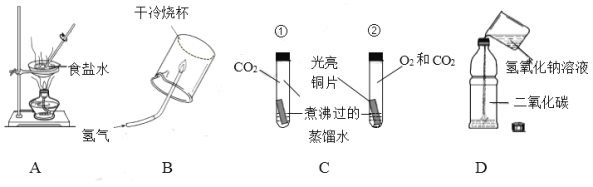
【题目】下列实验进行中的现象或实验原理正确的是( )
A. 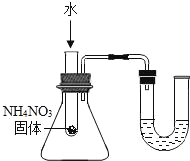 U型管内液面左高右低
U型管内液面左高右低
B. 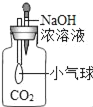 小气球变瘪
小气球变瘪
C. 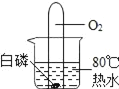 白磷始终不燃烧
白磷始终不燃烧
D. 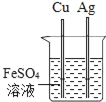 验证Fe、Cu、Ag的金属活动性强弱
验证Fe、Cu、Ag的金属活动性强弱
【答案】A
【解析】
A、根据硝酸铵溶于水吸热,使瓶内的压强减小;
B、根据氢氧化钠与二氧化碳反应使瓶内的压强变小分析;
C、根据燃烧的条件分析;
D、根据金属与盐反应的条件考虑本题,能反应说明该金属排在盐中金属的前面,不反应说明该金属排在盐中金属的后面。
A、硝酸铵溶于水吸热,使瓶内的压强减小,使U型管两端的液面左高右低,选项A正确;
B、氢氧化钠与二氧化碳反应使瓶内的压强变小,使气球涨大,选项B不正确;
C、热水的温度是80℃已经达到白磷的着火点,又与氧气接触,所以可以燃烧,选项C不正确;
D、铜和银都不能与硫酸亚铁溶液反应,只能说明它们排在了铁的后面,但不能排铜和银的顺序,选项D不正确。故选A。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】中和反应在日常生活中应用广泛,下列是稀盐酸和氢氧化钠溶液反应的微观示意图。回答以下问题:
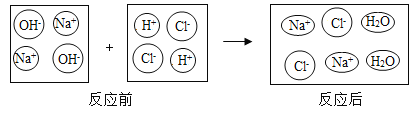
(1)分析图中反应前后没有发生变化的微粒是_____、_____;反应的实质是_____。
(2)如果规定上述反应后溶液的pH<7,显酸性。请你设计一个实验方案证明溶液显酸性:
实验操作 | 实验现象 | 实验结论 |
①______ | ②______ | 显酸性 |
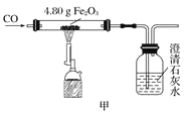
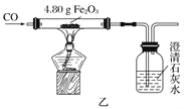
【题目】有一包未知粉末,其中含有碳酸钠、氢氧化钠、碳酸钙、生石灰、氯化钠、硫酸铜六种物质中的四种。兴趣小组为确定其组成设计并进行如下实验。
【实验一】甲组同学进行定性探究。
实验操作 | 实验现象 | 实验结论及分析 |
(1)取少量该未知粉末于烧杯中,加入足量的水溶解、过滤。 | 粉末部分溶解, 得到白色滤渣和无色滤液。 | 原粉末中一定不含_____; 白色滤渣不一定是原粉末中的碳酸钙,其理由是_____(用化学方程式表示)。 |
(2)向滤液中滴加无色酚酞试液。 | 溶液变红 | 滤液中存在碱性物质。 |
(3)向(2)中滴加足量稀盐酸。 |
| 原固体粉末中一定含有Na2CO3。 |
【实验二】乙组同学进行定量探究。
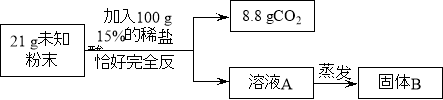
实验测得固体B中含15 g氯元素。试综合甲、乙两组同学的实验进行分析。
(1)乙组实验中一定发生的化学反应是:Na2CO3+ 2HCl=2NaCl + H2O+ CO2↑和 。
(2)该未知粉末的组成可能是 。
【题目】t1℃时,将甲、乙、丙三种固体各20克,分别加入盛有50克水的烧杯中,充分溶解后的情况如下表
物质 | 甲 | 乙 | 丙 |
未溶解的固体/g | 5.4 | 0 | 2 |
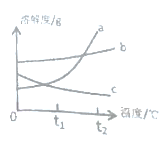
(1)一定是饱和溶液的是_______,t1℃时丙的溶解度为_______。
(2)图中表示固体甲的曲线是________。
(3)t1℃时,甲乙丙的溶解度大小关系为_______。
(4)t2℃时,取等质量的甲乙丙的饱和溶液,分别恒温蒸发等质量的水,析出溶质质量的大小关系为______(用甲乙丙表示)