题目内容
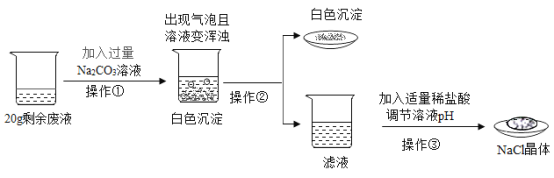
【题目】Ⅰ.配制一定溶质质量分数的氯化钠溶液的过程如图所示:
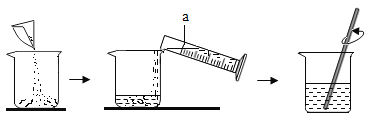
(1)写出图中标号a仪器的名称____________。
(2)称量氯化钠时,氯化钠应放在托盘天平的______________盘。 (填“左”成“右”)
(3)对配制的溶液进行检测发现溶质质量分数偏小,其原因可能有_____________ (填序号)
A 称量时,药品与砝码放反了
B 量取水的体积时,仰视读数
C 装瓶时,有少量溶液洒出
(4)把50g质量分数为15%的氯化钠溶液稀释成5%的氯化钠溶液,需要水的质量是_____________g.
Ⅱ.除去粗盐中难溶性杂质后,得到的固体中除了NaCl还含有少量的可溶性杂质MgCl2、CaCl2,某同学为除去可溶性杂质,将该固体加水溶解形成溶液A.并设计如下方案:
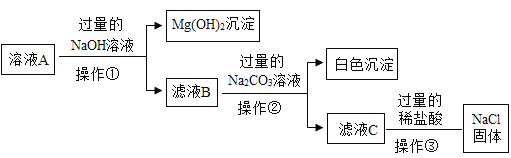
(1)操作①、操作②指的是_______________;
(2)滤液B中的溶质是_______________;
(3)加入过量的NaOH溶液发生反应的化学方程式为_______________;
(4)操作③中加过量的稀盐酸的目的是_______________.
【答案】量筒 左 AB 100 过滤 氯化钠、氢氧化钠、氯化钙 ![]() 除去过量的氢氧化钠和碳酸钠
除去过量的氢氧化钠和碳酸钠
【解析】
I、(1)由图可知,标号a仪器的名称是量筒,故填量筒。
(2)使用托盘天平时,应遵循左物右码的原则,所以称量氯化钠时,氯化钠应放在托盘天平的左盘上,故填左。
(3)A 根据托盘天平的平衡原理,正确称量时,药品的质量=砝码的质量+游码的示数,如称量时药品与砝码放反了,则药品的实际质量=砝码的质量游码的示数,称得药品的质量偏小,配制的溶液的溶质质量分数偏小;
B 量取水的体积时,仰视读数,读数小于液体的实际体积,则量取的水的体积偏大,配制的溶液的溶质质量分数偏小;
C 装瓶时,有少量溶液洒出,洒出的是配制好的溶液,不影响溶液的溶质质量分数,只是溶液的质量减少一些,故填AB。
(4)解:设加入水的质量为x
50g×15%=(50g+x)×5%
x=100g,故填100。
II、(1)操作①与操作②都是将难溶性固体与液体进行分离的操作,能够将难溶性固体与液体进行分离的操作是过滤,故填过滤。
(2)溶液A中含有氯化钠、氯化钙和氯化镁,向其中加入过量氢氧化钠溶液后,氢氧化钠与氯化镁反应生成氢氧化镁沉淀和氯化钠,过滤后,滤液B中的溶质有氯化钠、氯化钙和过量的氢氧化钠,故填氯化钠、氢氧化钠、氯化钙。
(3)溶液A中含有氯化钠、氯化钙和氯化镁,向其中加入过量氢氧化钠溶液后,氢氧化钠与氯化镁反应生成氢氧化镁沉淀和氯化钠,故反应的化学方程式写为:MgCl2+2NaOH=2NaCl+Mg(OH)2↓。
(4)由图可知,生产过程中,为彻底除去杂质氯化镁与氯化钙,向溶液中加入了过量的氢氧化钠溶液和碳酸钠溶液,所以滤液C中不仅有氯化钠,还有过量的氢氧化钠与碳酸钠,直接蒸发会造成得到的氯化钠晶体中含有杂质氢氧化钠与碳酸钠,所以向滤液C中加入过量的稀盐酸能够除去过量的氢氧化钠与碳酸钠,避免得到的氯化钠晶体中含有杂质,故填除去过量的氢氧化钠和碳酸钠。

【题目】下列有关物质的检验、区分、分离、提纯所用的试剂或方法错误的是
选项 | 实验目的 | 所用试剂或方法 |
A | 检验 | NaOH溶液或 |
B | 除去生石灰中含有杂质石灰石 | 水或稀盐酸 |
C | 从 | 过滤或蒸发 |
D | 区分失去标签的浓硫酸和稀硫酸 | 水或小木条 |
A. A B. B C. C D. D
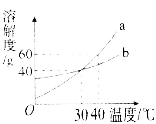
【题目】我国化学家侯德榜创立的侯氏制碱法为纯碱工业技术发展做出杰出贡献。在制备纯碱过程中涉及Na2CO3、NaCl、NH4Cl、NaHCO3等物质。请结合下表数据回答:
温度/°C | 0 | 10 | 20 | 30 | 40 | 50 | 60 | |
溶解度/g | Na2CO3 | 7 | 12.2 | 21.8 | 39.7 | 48.8 | 47.3 | 46.4 |
NaCl | 35.7 | 35.8 | 36.0 | 36.3 | 36.6 | 37.0 | 37.3 | |
NH4Cl | 29.4 | 33.3 | 37.2 | 41.4 | 45.8 | 50.4 | 55.2 | |
NaHCO3 | 6.9 | 8.2 | 9.6 | 11.1 | 12.7 | 14.5 | 16.4 | |
(1)在50°C时,向100g水中加入48gNa2CO3充分搅拌所得溶液质量为______,保持烧杯中各物质质量不变,降温至40°C时,所得溶液溶质的质量分数会____(填“变小”、“不变”或“变大”)。
(2)根据表中四种物质的溶解度,回答下列问题:
①60°C时,分别向等质量的四种固体物质中加水配成饱和溶液,所得溶液质量最大的是__。
②侯氏制碱法的原理是:NaCl+NH3+H2O+CO2=NH4Cl+NaHCO3,在生成物碳酸氢钠和氯化铵中,先析出的是_______,理由是_______。