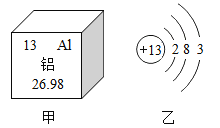
题目内容
【题目】为测定某石灰石样品中碳酸钙的含量,取样品10g于烧杯中,再向其中加入稀盐酸60g,恰好完全反应(杂质不参加反应),反应后烧杯中的物质总质量为66.7g.
(1)生成CO2的质量m1为 ___________g.
(2)求石灰石样品中碳酸钙的质量分数_______.
(3)工业上煅烧石灰石也可得到CO2,取上述样品10g,用这种方法生成的CO2质量为m2,则m1______m2.
【答案】3.3 75% =
【解析】
(1)根据质量守恒定律,恰好完全反应后生成二氧化碳的质量=60g+10.0g-66.7g=3.3g;
(2)样品中碳酸钙的质量为x。
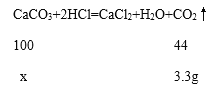
![]() x=7.5g;
x=7.5g;
样品中碳酸钙的质量分数=![]() ;
;
(3)由于碳酸钙和盐酸反应与碳酸钙高温分解生成的二氧化碳都是来源于碳酸钙中的碳酸根,而样品质量相同,故生成的二氧化碳质量相同,即m1=m2。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】下列有关化学实验的“操作——现象——结论”的描述都正确的是
选项 | 操作 | 现象 | 结论 |
A | 将高锰酸钾固体充分加热 | 固体全部消失 | 高锰酸钾易分解 |
B | 将砂纸打磨过的铝丝浸入硫酸铜溶液中 | 铝丝表面有铜析出 | 铝比铜活泼 |
C | 将一氧化碳气体通过灼热的氧化铜 | 黑色粉末变红 | 一氧化碳具有还原性 |
D | 将集满二氧化碳的试管倒置于水槽中 | 试管中水面上升 | 二氧化碳能溶于水 |
A. A B. B C. C D. D
【题目】化学小组围绕“铁丝在氧气中燃烧现象及产物”的问题,进行了相应的探究活动。
活动1:“火星四射”的现象与铁丝含碳量的关系
实验操作 | 实验现象 | 实验结论 |
实验1:取直径0.20mm,含碳0.1%的铁丝,在氧气中燃烧 | 零星火星 | 铁丝燃烧的符号表达式是___________________ “火星四射”与铁丝含碳量的关系是_____________。 |
实验2:取直径_____mm,含碳0.3%的铁丝,在氧气中燃烧 | 较明显的火星四射 |
活动2:黑色固体中是否含有铁?
资料:①铁粉和四氧化三铁为黑色固体,均具有磁性,可用磁铁吸引。
②铁、四氧化三铁均能溶于稀盐酸(即:铁 + 盐酸 →氯化亚铁 + 氢气;四氧化三铁+盐酸→氯化铁+氯化亚铁+水)
③氯化亚铁溶液为浅绿色,氯化铁溶液为黄色。
小明质疑小刚用磁铁来检验黑色固体是否含有铁的方案,其理由是________;同学们都认可了下列实验方案:
实验操作 | 实验现象 | 实验结论 |
取少量黑色固体于试管中,加入一定量__________,放置一段时间 | 有气泡产生,溶液由无色变为黄色 | 黑色固体中含有铁 |