题目内容
【题目】闪锌矿(主要成分为ZnS)经熔烧得锌熔砂,锌熔砂主要含ZnO、ZnFe2O4,以及少量CuO,工业上用其制备金属锌,具体过程如图所示。
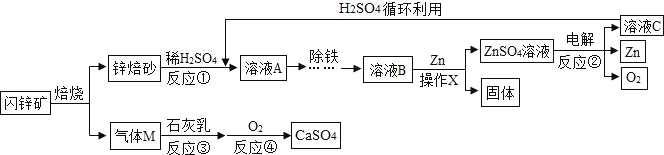
(1)进行反应①时,要将锌熔砂粉粹成细小颗粒,目的是_____。
(2)操作X的名称是_____;经该操作得到的ZnSO4溶液仍然浑浊,可能的原因是_____。
(3)ZnFe2O4可看作两种氧化物的结合物,与稀H2SO4反应产生两种盐,分别是ZnSO4和_____(填化学式)。
(4)参加反应②的物质为ZnSO4和_____(填化学式)。
(5)气体M如果直接排放,会造成的大气污染,气体M为_____(填名称)。
(6)写出反应④的化学方程式_____。
【答案】增大反应物的接触面积,使反应更加充分快速 过滤; 漏斗内的液面高于滤纸的边缘 Fe2(SO4)3 H2O 二氧化硫 2CaSO3+O2=2CaSO4
【解析】
(1)增大反应物的接触面积可以加快反应的速率,所以进行反应①时,要将锌熔砂粉粹成细小颗粒,目的是加快反应的速率;故填:增大反应物的接触面积,使反应更加充分快速;
(2)过滤可以将不溶性固体从溶液中分离出来,操作X的名称是过滤,经该操作得到的ZnSO4溶液仍然浑浊,可能的原因是漏斗内的液面高于滤纸的边缘或滤纸破损等;故填:过滤;漏斗内的液面高于滤纸的边缘;
(3)ZnFe2O4可看作氧化锌、氧化铁两种氧化物的结合,氧化锌和硫酸反应生成硫酸锌和水,氧化铁和硫酸反应生成硫酸铁和水;故填:Fe2(SO4)3;
(4)硫酸锌、水在通电的条件下生成锌、硫酸和氧气,故填:H2O;
(5)化学反应前后,元素种类不变,原子个数不变,所以气体M是SO2.故填:二氧化硫;
(6)亚硫酸钙与氧气反应生成硫酸钙;故填:2CaSO3+O2=2CaSO4。

 发散思维新课堂系列答案
发散思维新课堂系列答案【题目】实验室有一包固体药品,可能含有BaSO4、Na2CO3、CuSO4、NaCl、CaCl2、NaOH中的一种或几种,为确定其成分,某班同学在老师的指导下进行探究。
(一)定性探究:
Ⅰ.称取少量样品,加入足量水中充分溶解,过滤后得到白色沉淀和无色滤液。由实验现象可知,原固体中一定不含____;
Ⅱ.取Ⅰ中得到的滤液少量,设计实验继续探究原固体的成分,请帮他们完成实验报告并回答问题。
操作 | 现象 | 结论 |
向滤液中加入足量氯化钙溶液 | 产生白色沉淀 | 原固体中一定含有____ |
取上层清液,滴加____ | ____ | 原固体中不含NaOH |
其中,步骤加入足量氯化钙溶液的目的除了检验一定含有的物质外,还能起到的作用是____;
Ⅲ.再取Ⅰ中得到的滤液少量,进行如下操作:
![]()
同学们认为:原固体中一定含有NaCl。但是老师指出这个结论不正确,其理由是___(填序号)
A.滤液中含有Na2CO3,也能和AgNO3反应生成沉淀
B.滤液中的NaCl可能是由原固体中的Na2CO3和CaCl2反应生成
(二)定量探究:
在老师的指导下同学们又精确称量了10g原固体,进行如下实验:
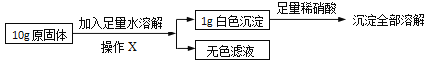
同学们认为,根据“沉淀全部溶解”的现象可确定白色沉淀的成分是____,则原固体中一定不含____;其中,操作X的名称是____,无色滤液中一定含有的阳离子是____。
试根据生成沉淀的质量计算原固体中氯化钙的质量分数,写出计算过程_____。